NIVEL BÁSICO
I.-Masas y volúmenes en las reacciones químicas.
a. Masas atómicas relativas.Cálculo de la masa molecular.
1.- Calcula la masa molecular relativa del SO3, C2H6, H3PO4, H2SO4.
b. Mol. Molaridad.
2.- Calcular la masa de un mol : a) de átomos de N b) de moléculas de nitrógeno
c) moléculas de agua.
3.- Si la masa fórmula relativa del Na Cl es 58,5 ¿ Cuál es la masa de 1 mol de unidades fórmula?
c. Cálculos basados en las ecuaciones
4.- La caliza, carbonato calcico, se descompone en un horno a alta temperatura quedando un residuo sólido de oxido de calcio y desprendiéndose dióxido de carbono. Determinar la cantidad de caliza necesaria para obtener 500 kg. de cal viva (oxido de calcio).
5.- El agua se descompone por acción de la electricidad mediante el proceso de la electrólisis del agua acidulada. Se utiliza un voltámetro de Hoffman que permite obtener los dos gases, hidrógeno y oxígeno, productos de la reacción, uno en cada electrodo.
a) Escribir la ecuación química ajustada.
b) Calcular el volumen de cada gas, medido en condiciones normales que se obtiene cuando se han descompuesto 18 g de agua.
II.- La energía en las reacciones químicas.
Reacciones exotérmicas y endotérmicas.
1.- Reacción exotérmica: Sulfito de sodio y lejía
Procedimiento
a. Coloca 50 ml de lejía en un vaso de 250 ml . Mide la temperatura.
b. Añadir 50 ml de solución de sulfito de sodio.
c. Comprobar el incremento de temperatura.
Esta reacción es altamente exotérmica; la temperatura debe incrementar en unos 20 °C.
SO32-
(ac) + 2ClO-(ac) ![]() SO42- (ac) + 2Cl-(ac)
+ calor
SO42- (ac) + 2Cl-(ac)
+ calor
La solución de sulfito de sodio es 0.5 M: 6.3 g de Na2SO3 en 100 ml de solución.
La lejía es una solución de 5.25% de NaOCl.
2.- Se añade ácido a un vaso de agua a O °C y en otro a hielo a O °C . El cambio de temperatura es apreciablemente diferente en cada caso.
Procedimiento
a. Colocar l00 g de agua a O °C un termómetro en un vaso de plástico con tape.
b. Colocar 100 g de hielo a O °C y un termómetro en otro vaso.
c. Tener preparadas dos porciones de 100 ml a temperatura ambiente de ácido sulfúrico 9 M.
d. Añadir estas porciones en cada vaso y anotar los aumentos de temperatura
3.- El calor de disolución del ácido en agua produce un aumento de temperatura en el primer vaso. El descenso en la temperatura del segundo vaso se produce hasta unos - 15 °C. Cualquier calor generado en la hidratación del ácido es absorbido por el cambio de fase de las moléculas de agua..
H2SO4
(ac) + H2O ![]() H3O+ (ac) + HSO4-
(ac) + calor
H3O+ (ac) + HSO4-
(ac) + calor
H2O(s)
+ calor ![]() H2O(g)
H2O(g)
ácido sulfúrico 9M: Se diluye el ácido concentrado colocando 100 ml de agua en un vaso o matraz y se añade ácido hasta alcanzar un volumen total de 200ml.
El ácido añadido al agua aumentará la temperatura 18-20 °C.
El ácido añadido al hielo bajara la temperatura 15 °C.
4.- Comentar algunas aplicaciones industriales y domésticas de las reacciones exotérmicas.
5.- Realizar reacciones endotérmicas en las que se debe aportar
energía calorífica. La descomposición térmica del carbonato de calcio(mármol) con producción de dióxido de carbono que se puede detectar y el sólido que queda se puede rayar con facilidad y añadiendo agua la solución adquiere carácter básico.
Al calentar el clorato de potasio se desprende oxígeno fácilmente identificable.
6.- Realizar reacciones en las que se desprende energía :
Acción del ácido clorhídrico sobre el cinc.
Sobre un vaso de plástico de un solo uso colocado en el interior se añade H Cl concentrado sobre amoniaco concentrado se desprende calor suficiente para fundir el vaso.
7.- Sobre un poco de KMnO4 se añaden unas gotas de ácido sulfúrico se desprende calor suficiente para iniciar la combustión de un algodón empapado en alcohol.
Añadir glicerina sobre KMnO4.
8.-Clasifica las siguientes reacciones como exotérmicas o endotérmicas:
a) combustión de la gasolina
b) crecimiento de las plantas debido a la fotosíntesis
c) reacciones químicas en la batería de un coche cuando está parado.
d) la producción de luz en los fuegos artificiales
e) en la electrólisis del agua.
9.- La respiración es un proceso químico en el que :
a) se forma CO2 a partir de los alimentos ingeridos.
b) Se desprende energía y es exotérmico.
c) Se desprende energía y es endotérmico.
d) Se absorbe energía
10.- Indica de la siguientes reacciones las que son exotérmicas:
a) la fotosíntesis
b) la descomposición de un compuesto en sus elementos.
c) La explosión de la dinamita.
d) La combustión de un árbol.
11.-Medida de la energía intercambiada en una reacción
Se disuelven 6 g de CuSO4.5H2O en 250 ml; se mide la temperatura de la disolución. Se añaden 1.7 g de Zn . Se mide de nuevo la temperatura cuando la reacción concluya que es cuando la disolución azul pierda su coloración.
CuSO4( ac) + Zn(s) ![]() Cu(s) + Zn SO4 (ac)
Cu(s) + Zn SO4 (ac)
Calcular la energía
desprendida tomando como válida la capacidad calorífica específica la del agua
4180 J/ kg K y aplicando la fórmula de Q= m·4180·Dt y dar el resultado
en kJ por mol de cinc.
III.- Velocidad de las reacciones.
a) Su expresión.
b) Factores que influyen .
1.- Carbono como Catalizador
Intenta arder un cubo de azúcar sujeto con unas pinzas y no arde. Tomar otro cubo y cubrirlo por lo menos dos veces con cenizas de cigarrillo y al calentarlo con una llama arde.
El carbono de las cenizas del cigarrillo actúa como catalizador en la combustión del azúcar .
1. El carbono en polvo actuará mejor que las cenizas del cigarrillo.
2. El punto de fusión de la sacarosa es 185 °C.
2.- Influencia de la temperatura en la velocidad de reacción
a. Colocar 150 mL de agua caliente en un vaso.
b. Colocar la misma cantidad de agua fría en otro vaso.
c. Poner una tableta de Alka Seltzer en cada vaso.
d. Anotar el tiempo que emplea en reaccionar.
Alka Seltzer contiene dihidrogenofosfato de calcio, Ca(H2PO4)2; ácido cítrico, aspirina, e hidrogenocarbonato de sodio NaHCO3
El dihidrogenofosfato de calcio, Ca(H2P04)2 es una fuente de ión hidrogeno :
Ca(H2PO4)2(s)
![]() 2H+(ac) + 2(HPO4)2- (ac)+
Ca2+ (ac)
2H+(ac) + 2(HPO4)2- (ac)+
Ca2+ (ac)
El bicarbonato de sodio es una fuente de ión, HC03-:
NaHCO3(s)
![]() Na+(aq) + HCO3- (aq)
Na+(aq) + HCO3- (aq)
El H+, HC03-, and H2O reaccionan para producir dióxido de carbono:
H+(aq)
+ HCO3-(ac) + H2O( l ) ![]() CO2(g) + 2H2O(1 )
CO2(g) + 2H2O(1 )
¿ Qué generalización sobre la velocidad de reacción se puede concluir de esta experiencia?
¿ Cómo sería la velocidad de la reacción a la temperatura ambiente comparando con agua fría? ¿ y con agua caliente?
4.-Las patatas, al cocerse, sufren una transformación química. Teniendo esto en cuenta, ¿Hay alguna forma de acelerar la cocción de las patatas?
5.-¿ Cuál es el fundamento de una olla a presión?
6.-Comentar la siguiente frase: Un catalizador modifica la velocidad de una reacción transformándose en el proceso.
7.-Copia y completa las siguientes frases:
A Un catalizador es una sustancia que ........... la velocidad de una reacción.
B Un catalizador .... .... durante la reacción.
8.-Los catalizadores pueden conseguir que las reacciones a temperatura más baja de lo habitual ¿Porqué los técnicos de la industria piensan que es una buena idea?
9.-Encontrar información sobre los conversores catalíticos de los automóviles?
a) ¿ Cómo funcionan los conversores catalíticos?
b) ¿ Cuáles son las ventajas?
c) ¿ Cuáles son las desventajas?
10.-En un experimento se descompuso H2O2, desprendiéndose 5 litros de oxígeno medidos en condiciones normales en un cuarto de minuto. En un segundo experimento, el H2O2 produjo, al descomponerse, 2 litros de oxígeno en 8 segundos. ¿En cual de ellos la descomposición fue mas rápida?
11.-Los alimentos congelados se conservan frescos durante meses. Los mismos alimentos se estropean rápidamente si se almacenan a temperatura ambiente. ¿Cuál es la razón de esta diferencia?.
12.-Un trozo entero de carne se conserva mucho más tiempo que cuando se corta en pequeños
fragmentos. Explica la razón.
13.-¿Por que el tubo de escape de un coche se oxida mas rápidamente que el resto de la carrocería?
14.-¿Porqué la leche se agria mas rápidamente si está en la intemperie?
15.-Se coloca en una probeta sobre un fregadero 50 ml de agua oxigenada(30%) ,un chorro de detergente lava vajillas y un cuarto de cuchara de KI sólido cataliza la reacción de producción de oxígeno.
Esta reacción también puede ser catalizada por la catalasa un enzima existente en la sangre, por lo que se podría investigar el efecto que producirá un trozo de hígado de animal.
 16.-En la fermentación de la glucosa
se puede medir la velocidad de reacción contando el número de burbujas de CO2
producidos por minuto. Esta gráfica indica la dependencia de la velocidad de
reacción con la temperatura ¿ Cuál es el intervalo de temperatura para obtener
más deprisa el etanol y el dióxido de carbono.
16.-En la fermentación de la glucosa
se puede medir la velocidad de reacción contando el número de burbujas de CO2
producidos por minuto. Esta gráfica indica la dependencia de la velocidad de
reacción con la temperatura ¿ Cuál es el intervalo de temperatura para obtener
más deprisa el etanol y el dióxido de carbono.
17.-Ana quiere investigar la reacción entre el Mg y el H Cl . Ha realizado 5 experiencias y obtiene los siguientes valores:
| Experimento | 1 | 2 | 3 | 4 | 5 |
| Tiempo en recoger 10 cm3 de hidrógeno (s) | 15 | 6 | 43 | 15 | 29 |
¿ Qué experimento se produce con mayor velocidad?
¿ Qué experimento se produce con menor velocidad?
Ana dice que solo ha variado la temperatura. ¿ Qué experiencia se ha realizado a mayor temperatura?
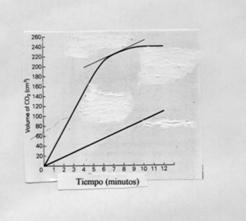 18.-
Un grupo de estudiantes deciden investigar el efecto de la concentración de
H Cl en la velocidad de reacción con el carbonato cálcico. Ellos repiten el
experimento dos veces , primero usando H Cl 1M y posteriormente H Cl 2 M
. Con la misma masa y tamaño de los fragmentos de mármol. Recogen sus datos
en la siguiente gráfica . ¿ Qué información puedes extraer de la gráfica ? .
Explica el significado el cambio de pendiente con el tiempo de la linea que
representa uno de los experimentos.
18.-
Un grupo de estudiantes deciden investigar el efecto de la concentración de
H Cl en la velocidad de reacción con el carbonato cálcico. Ellos repiten el
experimento dos veces , primero usando H Cl 1M y posteriormente H Cl 2 M
. Con la misma masa y tamaño de los fragmentos de mármol. Recogen sus datos
en la siguiente gráfica . ¿ Qué información puedes extraer de la gráfica ? .
Explica el significado el cambio de pendiente con el tiempo de la linea que
representa uno de los experimentos.
19.-¿ Cómo puede un cuerpo humano a la temperatura de 37 0C quemar el azúcar ?
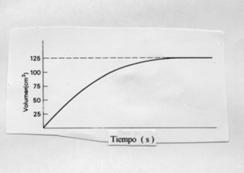
20.- La gráfica representa el volumen desprendido
de oxígeno por el agua oxigenada al actuar
un catalizador. Copia la gráfica y dibuja en la misma otras gráficas en las
que se refleje lo que ocurriría si utilizásemos a) doble cantidad de catalizador
b) mayor temperatura.
IV.-ÁCIDOS Y BASES
1.- Explorando ácidos y bases. Preparar un extracto de col lombarda. Examina la etiqueta de una botella de vinagre blanco, donde indica que contiene ácido acético, y coloca 125 ml en un vaso de agua y añade 5 ml( una cucharada de extracto de col lombarda, agitar y anotar el color de la mezcla. guarda la mezcla en el vaso para usarlo como referencia en el resto del experimento,Ahora examina el efecto del amoniaco limpiacristales, repitiendo el proceso anterior con las mismas cantidades.
Ahora comprueba las propiedades de un sólido, el bicarbonato. coloca una cucharada en un vaso de agua, agita hasta disolverlo. Entonces añadir una cucharada del extracto de col lombarda.
Determinar el valor aproximado del pH utilizando la siguiente tabla:
| pH aproximado | 2 | 4 | 6 | 8 | 10 | 12 |
| color del extracto | rojo | pùrpura | violeta | azul | azul-verdoso |
Usando esta tabla, o el papel indicador universal o un pH-metro portátil, determinar el pH de líquidos incoloros tales como las bebidas Sprite, 7-Up, gaseosas, jugo de limón; la leche aunque líquido blanco se puede determinar el pH de la misma forma. Para sólidos y líquidos viscosos se puede seguir el procedimiento utilizado con el bicarbonato.
Comprobar el color y el valor del pH de sustancias que dispongamos en nuestra vivienda tales como azúcar, sal, champù, pasta dental, aspirina, aspirina efervescente, tabletas de antiacidez de estomago, líquido desatascador, salfumán, alcohol, yoghourt, leche que ha estado abierta varios días fuera del frigorífico, polvos de limpieza (sosa solvay).....
2.-En la picadura de una hormiga y en la de una abeja y en las ortigas hay un ácido y en la de una avispa y de medusa una base. ¿ Qué utilizarías en cada caso para aliviar su efecto (escozor)?
3.-Comprobar los colores que adquieren varios indicadores (tornasol, fenolftaleína, anaranjado de metilo, extracto de flores...) con sustancias ácidas, básicas y neutras.
4.-¿ Cómo se origina y cuáles son las consecuencias ambientales de la lluvia ácida?
5.-¿Por que se usa el vinagre, en vez de salfuman, para eliminar los residuos calcáreos de resistencias en contacto con el agua? ¿Por que no se utiliza sosa caústica NaOH para reducir la acidez de estomago?
6.-Di que ácidos hay a) en una aspirina b) en el vinagre c) en el limón
d) en las hormigas e) en la batería de los coches f) en nuestro estomago
7.-Copia y completa:
a) ¡ácidos reaccionan con metales para producir .... y ....
b) ¡ácidos reaccionan con bases para producir ....
c) ácido + ...................... ![]() sal+ ........
sal+ ........
d) Bases neutralizan a .........
f) Sulfatos se originan con el ácido
g) Cloruros se originan con el ácido
h) Nitratos se originan con el ácido
8.-Ainhoa dice "Yo pienso que la leche se vuelve más ácida si deja un tiempo prolongado fuera del frigorífico"
Planifica una investigación para comprobar si es cierta dicha afirmación.
9.-Analizando suelos
Coloca 2 espátulas de suelo en un tubo de ensayo y añade 10 ml de agua destilada¿ tapar el tubo y agitar durante un minuto, filtrar y medir le pH del líquido
Repetir este test con varios suelos
a ¿Porqué se utiliza agua destilada en este test?
b ¿ Porqué agita durante un minuto?
c ¿Qué suelo es el más ácido?
d ¿ Qué suelo es el más alcalino?
10.-El pH que favorece el crecimiento de los siguientes productos es
| manzana | 5- 6,5 | cebolla | 6-7 |
| patata | 4,5- 6 | fresa | 5-7 |
| grosella | 6-8 | lechuga | 6-7 |
| menta | 7-8 |
11.-La cal tiene un pH aproximado de 9 y el ácido cítrico tiene un pH aproximado de 4.
¿ Qué añadirías a un suelo neutro si deseas que crezcan bien las manzanas?
12.-Realizar un trabajo sobre las precauciones que se debe tener en la manipulación del ácido sulfúrico, clorhídrico, nítrico y la sosa cáustica.