NIVEL PROPEDEÚTICO
I.- Masas y volúmenes en las reacciones químicas.
a. Masas atómicas relativas.Cálculo de la masa molecular.
1.- Define la u.m.a.
2.- ¿ Qué quiere decir que la masa atómica relativa del oxígeno es 16 ?
3.- Establecer con claridad los conceptos de : masa atómica relativa, masa molecular relativa, masa fórmula relativa y masa molar.
4.- ¿ Cuántos gramos de S hay en 100 g de SO3?
b Constante de Avogadro. Mol. Molaridad.
Reflexiones sobre el número de Avogadro. Si las partícula que indica este número se convirtieran en bolas de 1 cm de diámetro y se colocaran tocándose unas con otras sobre la península ibérica, se formarán capas con la que se alcanzaría 1000 km. de altura.
Si fueran guisantes de volumen 0,1 cm3 cubrirían Estados Unidos con una altura de 6 km.
Si fueran granos de trigo y se pudieran contar 100 por minuto. Una persona sería capaz de contar 4 mil millones en toda su vida.
Si todas las personas que han vivido en la Tierra hubieran utilizado sus vidas en contar granos de trigo , la cantidad contada estaría lejos del 6,022. 1023.
Un mol de granos de trigo es mucho más que el trigo producido en la historia humana.
Si dispusiéramos de un sistema automático capaz de contar mil millones por segundo, la tarea de contar el número de Avogadro le tendría entretenido durante 20 millones de años.
5.- Sí 6,02. 1023 bolas de 1cm de diámetro cubrirían la península ibérica con un una altura de 1000 km .¿ Qué altura alcanzarían si cubrieran solo Navarra?
6.- Define el concepto moderno de mol.
7.- En 40 moles de amoniaco. ¿ Cuántas moléculas hay? ¿ y átomos de hidrógeno?
8.-En 100 g de CaCO3 ¿ Cuántos átomos de oxígeno hay?
9.- Si evaporamos 2 litros de disolución de NaCl 3M ¿ Cuál será la masa de sólido que queda de residuo?
10.- En 2 litros de disolución de NaOH 0,5 M hay :
a) 20 g de NaOH
b) 2 moles de NaOH
c) 0,5 moles de NaOH
d) 40 g de NaOH
11.- El concepto de molaridad de una disolución es:
a) moles de soluto que existen en 1000 ml de disolución
b) el cociente entre moles de soluto y los litros de disolvente.
c) moles de soluto que se deben disolver en 1 litro de disolvente
d) el cociente entre los moles de soluto y la masa molecular del soluto y los litros de disolvente.
c. Cálculos basados en las ecuaciones
12.- Si se descomponen diez moléculas de agua, ¿cuántas moléculas de oxígeno y de hidrógeno se obtienen?
¿ Cuantos gramos de oxígeno y de hidrógeno se obtienen a partir de 180 g de agua?
13.- A partir de ecuación ajustada
3 Cu(s) + 8 HNO3(ac) ![]() 3
Cu(NO3)2(ac) + 2 NO(g) + 4 H2O(l)
3
Cu(NO3)2(ac) + 2 NO(g) + 4 H2O(l)
Determinar la masa de cobre que producirá 0,167 moles de NO(g) si reaccionan con ácido nítrico en exceso.
a) 10,6 g b) 31,8 g c) 190,6 g d) 5,01 g e) 15,9 g
14.- Calcula la cantidad de oxigeno que se necesita para reaccionar totalmente con 12 kg. de carbono:
a) En el caso que se forme CO. b) En el caso que se forme C02.
15.- 80 gramos de un metal M, cuya masa atómica relativa es igual a 40, se oxidan con 32 gramos de oxigeno gaseoso
a) ¿cuantos moles de oxígeno reaccionan con un mol del metal?
b) ¿Cuál es la formula del oxido de ese metal?
16.- La síntesis
del amoniaco en la industria es a partir de nitrógeno e hidrógeno. ¿ Cuántos
litros medidos en condiciones normales de cada unos de estos gases serán necesarios
para obtener 100 litros de amoniaco?
II.- La energía en las reacciones químicas.
- Reacciones exotérmicas y endotérmicas.
1.- Reacción Exotérmica : Cloruro de calcio sólido se añade al agua y la temperatura del agua aumenta.
Procedimiento:
Anota la temperatura de 100 ml de agua y añade de 10 a 15 g de cloruro de calcio
Mide el incremento de temperatura .
El calor de solución para el cloruro de calcio es de 117 calorías por 100 ml de agua:
CaC12(s) + H20(l)
![]() Ca2+(ac)
+ 2Cl- (ac) + calor
Ca2+(ac)
+ 2Cl- (ac) + calor
El incremento de temperatura es de unos 12 °C.
Utilizar un vaso de plástico para conseguir una mayor exactitud en la medida del cambio de temperatura
Se puede utilizar óxido de bario en lugar de cloruro de calcio.
2.- Cita algunos ejemplos de reacciones en los que la energía intercambiada no sea calorífica
3.- Indica cuáles de las siguientes reacciones son : endotérmicas y cuáles exotérmicas:
a) H20 (1) + 286 kJ ![]() H2 (g)
+ 2 O2 (g)
H2 (g)
+ 2 O2 (g)
b) CaC03 (s) ![]() CaO
(s) + CO2 (g) + 178,3 kJ
CaO
(s) + CO2 (g) + 178,3 kJ
c) 2 C (s) + 2 H2 (g) ![]() C2H4
(g) DH = +52,3 kJ
C2H4
(g) DH = +52,3 kJ
d) Si (s) + 2 C12 (g) ![]() SiC14 (g)
DH = -657 kJ
SiC14 (g)
DH = -657 kJ
4.- Se coloca 100 ml de agua en un vaso de precipitados, se añaden 12 g de nitrato de amonio que al disolverse en agua disminuye la temperatura alrededor de 7oC. Se calcula la cantidad de energía absorbida. Se pasa a los alumnos para noten la sensación de frío. Si coloca el vaso sobre un poco agua en la mesa, esta se congela.
5.- Se coloca en un vaso de 50 ml unos 20 g de Ba(OH)2.8H2O y se añaden 10 g de NH4SCN se agitan los dos sólidos, la temperatura puede bajar en torno a los
20o C . De esta forma se comprueba que no es necesario la presencia de una solución para intercambiar energía. Se puede reemplazar el NH4SCN por 7 g de NH4Cl o 10 g de NH4NO3.
6.- Mezclar sacarosa con clorato potásico
y se añade unas gotas de ácido sulfúrico se produce energía para iniciar la
combustión de la sacarosa, si se añade sales como CuCl2 o SrCl2
la llama varía de coloración.
III.- Velocidad de las reacciones.
a) Su expresión.
b) Factores que influyen.
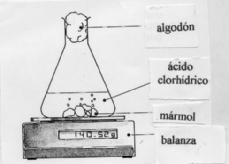 1.-Realización
de medidas de la velocidad de reacción midiendo algo que cambie en la reacción.
Colocar un matraz erlenmeyer con trozos de mármol sobre una balanza, se añade
ácido clorhídrico y se coloca un trozo de algodón que tape la boca. Se anota
la masa en distintos instantes (cada 15 segundos), se confecciona una tabla
y se construye una gráfica, comentando los resultados.
1.-Realización
de medidas de la velocidad de reacción midiendo algo que cambie en la reacción.
Colocar un matraz erlenmeyer con trozos de mármol sobre una balanza, se añade
ácido clorhídrico y se coloca un trozo de algodón que tape la boca. Se anota
la masa en distintos instantes (cada 15 segundos), se confecciona una tabla
y se construye una gráfica, comentando los resultados.
2.- Si al realizar la experiencia anterior se mide la disminución de masa que indica la balanza cada 2 minutos se obtienen los siguientes valores en la balanza:
| Tiempo (minutos) | 2 | 4 | 6 | 8 | 10 |
| Disminución de masa | 1 | 0.8 | 0.7 | 0.6 | 0.5 |
Representar la gráfica de los gramos de CO2 producidos frente al tiempo.
¿ Cuál es el valor de la velocidad media de reacción expresada en gramos de CO2 producidos por minuto, en los dos primeros minutos y en los dos últimos?
3.- Dibuja una gráfica con los resultados de las dos experiencias sobre la reacción entre H Cl y CaCO3. En las dos se ha utilizado H Cl 1M , pero en una se han utilizado trozos pequeños y en otra grandes:
| Tiempo ( minutos) | Volumen de CO2 (cm3) | Volumen de CO2 (cm3) |
| 2 | 18 | 54 |
| 4 | 36 | 108 |
| 6 | 54 | 162 |
| 8 | 72 | 206 |
| 10 | 90 | 230 |
Indica qué columna se refiere a la experiencia con trozos pequeños.
¿ Calcúla la velocidad de reacción en cm3/minuto en las dos experiencias entre los minutos 4 y 10?
4.-Cobre catalítico
Se disuelve una cucharada de sulfato de cobre CuS04 .5H20 en 200 ml y se lleva a ebullición en un matraz de 500 mL .
Mezcla 6.4 g de cobre en polvo y 3.2 g de azufre en polvo.
Agitar dentro de la disolución de sulfato de cobre .
Continuar la mezcla en ebullición y agitando.
8 Cu(s) + S8 (s) ![]() 8 CuS(s)
8 CuS(s)
Usando dos veces mas de cobre que de azufre da una mezcla estequiométrica. Se puede intentar con exceso de azufre y comparar visualmente el resultado..
Es importante agitar continuamente. Usar agitador magnético si se dispone.
Esta reacción es un buen ejemplo de reacción entre dos sólidos.
El sulfato de cobre actúa como catalizador. Verificar el efecto catalítico utilizando agua hirviendo en lugar de la disolución.
5.-¿Cómo podrías comprobar, en la reacción del mármol (CaCO3) con el ácido clorhídrico, la influencia de la superficie de contacto entre los reactivos y la concentración de los reactivos en la velocidad de esta reacción?
6.- Alejandro quiere obtener y recoger dióxido de carbono gas
a) Dibuja un diagrama del dispositivo que puede utilizar, poniendo nombre a cada componente.
b) Describe 2 usos del dióxido de carbono .
| Tiempo (minutos) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Volumen (cm 3) | 0 | 20 | 35 | 45 | 50 | 52 | 52 | 52 | 52 |
a) Dibujar una gráfica de estos resultados.
b) ¿ Después de cuántos minutos la reacción ha terminado?
c) ¿Qué volumen de CO2 se ha recogido al final de la reacción?
d) ¿ Cuándo la reacción es más rápido al principio o al final de la reacción?
7.- El aluminio reacciona con ácido clorhídrico diluido desprendiéndose hidrógeno gaseoso. Disponemos de 45 gramos de aluminio. Razona cuales de las siguientes medidas hará que el aluminio reaccione antes:
a) Triturar el aluminio hasta reducirlo a polvo.
b) Diluir la disolución de HCI empleada.
c) Calentar la
mezcla reaccionante.
8.-El nitrógeno y el oxígeno reaccionan según la ecuación:
N2 (g) + O2 (g) ![]() 2 NO (g)
2 NO (g)
Para que se produzca esta reacción, es necesaria la ruptura previa de los fuertes enlaces covalentes existentes entre los átomos de nitrógeno de la molécula de N2.
Razona si esta reacción ocurrirá o no rápidamente a la temperatura ambiente.
9.- Al estudiar la descomposición del etanal a alta temperatura en un recipiente de 10 litros
CH3CHO (g) ![]() CH4 (g)
+ CO (g)
CH4 (g)
+ CO (g)
Se encontró que la concentración de etanal (CH3CHO) pasó de 0,0266 moles/litro a 0,0248 moles/litro en 5,4 minutos.
¿Cual es la velocidad media de la reacción en ese tiempo?
Exprésala en mol/l s y en g/s.
10.-.Enuncia factores de los que depende la velocidad de reacción. Para cada factor, da un ejemplo ilustrativo.
11.- Cita ejemplos de reacciones que transcurran
a) muy rápidas
b) muy lentas
c) a una velocidad moderada
12.- ¿Porqué algunas veces explota el polvo fino de harina de un molino?
13.- Se realiza un experimento para determinar a la velocidad en que el hidrógeno gas se desprende cuando cinc granulado se añade a ácido sulfúrico diluido. 100 cm3 de ácido diluido (0.1 M) se añaden a un exceso de cinc y el gas se recoge en un jeringa . Los resultados han sido:
| Tiempo(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Volumen (cm3) | 0 | 60 | 115 | 160 | 200 | 230 | 240 | 240 | 240 | 240 | 240 |
(a) Dibujar la gráfica de volumen de hidrogeno frente al tiempo, poniendo el tiempo en el eje horizontal.
(b) ¿ Para qué tiempo la velocidad de la reacción es mayor?.
(c) ¿ Cuál es la velocidad de reacción cuando han transcurrido 80 s?.
(d) ¿ Qué le sucede a la concentración del
ácido al avanzar la reacción?.
IV.- ÁCIDOS Y BASES.
1.-Se neutralizan 40 g de NaOH con ácido clorhídrico diluido. Al evaporar la disolución resultante ¿ Cuántos gramos de cloruro de sodio se obtendrán?
2.-Escribir las ecuaciones completas y ajustadas de las siguientes reacciones:
ácido clorhídrico+ oxido de hierro(II)
carbonato de calcio + ácido clorhídrico
ácido nítrico + hidróxido de bario
óxido de calcio + ácido sulfúrico
dióxido de carbono + hidróxido de calcio
ácido nítrico+ amoniaco
ácido clorhídrico + cinc
3.-El magnesio reacciona con ácido clorhídrico según la ecuación
Mg + 2 HCl ![]() MgCl2 + H2
MgCl2 + H2
¿ Cuál es la molaridad de la disolución del ácido clorhídrico si 500 ml reaccionan con 75 g de magnesio?
4.-Disponemos de las siguientes disoluciones :
ácido sulfúrico 3M
hidróxido de potasio 4M
ácido clorhídrico 1M
ácido nítrico 2M
hidróxido de calcio 5 M
Completar los volúmenes en las siguientes neutralizaciones
25 ml de ácido sulfúrico con ........... de hidróxido de calcio
50 ml de ácido sulfúrico con .......... de hidróxido de potasio
50 ml de ácido nítrico con .........de hidróxido de calcio
100 ml de ácido clorhídrico con.......de hidróxido de potasio
5.-Tenemos cuatro vasos que contienen uno 100 ml de HCl 1M, el segundo 100 ml de ácido acético 1M, el tercero 100 ml de cloruro sódico 1M y el cuarto
100 ml de NaOH 1m. Ordenar de menor a mayor según el valor del pH.
6.-Investigar la diferencia en la conductividad de electrólitos fuertes y débiles. Para ello tomamos los mismos volúmenes y de la misma concentración de ácido clorhídrico, ácido acético, hidróxido de sodio, amoniaco , se introducen unos electrodos a la misma profundidad y a la misma distancia conectados a la misma fuente de alimentación y se mide la conductividad con un amperímetro ( existen medidores de conductividad con forma de bolígrafo).
7.-Los pH determinados de varias disoluciones son los siguientes:
A pH=7, 2 B pH=2,5 C pH= 4,7 D pH=11 E pH=13
¿ Cuáles de ellas son ácidas y cuáles básicas?
¿ Cuál de ellas es la más ácida y por tanto posee la mayor concentración de iones H3O+ ?
¿ Cuál de ellas es la más básica y por tanto posee la mayor concentración de iones OH- ?
8.-Tenemos varios recipientes que contienen las siguientes disoluciones ácido clorhídrico 0,1 M, hidróxido de sodio 0,1 M , amoniaco 0,1 M , cloruro de sodio O,1 M, ácido acético 0,1 M . Indicar que hay en cada recipiente si al medir el pH de cada recipiente se han obtenido los siguientes valores:
A) pH= 7 B) pH= 13 C) pH= 2,5 D) pH= 11,1 E) pH=1
10.-¿Qué sucede cuando la lluvia ácida cae sobre un metal ? El mármol es carbonato de calcio .¿ Qué sucede cuando la lluvia ácida cae sobre una estatua de mármol?
11.-Indica que valor de pH es correcto en la siguientes afirmaciones
pH 6 ácido fuerte
pH 1 álcali fuerte
pH 11 ácido débil
pH 8 álcali débil
12.- Hay fármacos utilizados para combatir la acidez de estómago que contienen Al(OH)3 .
¿ En qué radica que sean más eficaces?.
13.- La cal ( CaO) se utiliza para corregir el pH de las tierras . ¿ En que sentido variará el pH?
14.- ¿ Qué reacción ocurrirá si se cae el vinagre sobre un suelo o encimera de mármol?