ACTIVIDADES.
NIVEL SUPERIOR
I.- Masas y
volúmenes en las reacciones químicas.
. a).- Masas
atómicas relativas. Cálculo de la masa molar.
1.- Escribe la
fórmula del nitrato amónico y la del fosfato amónico. Calcula la masa fórmula
relativa de cada uno y el tanto por ciento de nitrógeno en cada sal.
2.- De las siguientes afirmaciones
¿Cuál es la definición correcta de masa molecular de una sustancia?.
3.- La masa en:
-
a)
gramos obtenida al sumar las masas atómicas de los átomos ( en gramos) que
existen en la molécula de dicha sustancia.
-
b)
gramos de un mol de moléculas.
-
c)
umas del número de Avogadro de moléculas de la sustancia.
-
d)
umas obtenida al sumar las masas atómicas de los átomos ( en umas) que
existen en la molécula de dicha sustancia.
4.- ¿Es correcto
hablar de masa molecular relativa de un elemento?. ¿Por qué es más correcto
hablar de constante de Avogadro en lugar de número de Avogadro?.
5.- ¿ Qué diferencia
existe entre masa molecular relativa y masa molar ? ¿ En qué compuestos es
necesario utilizar el nombre de masa fórmula relativa ?
6.- Calcula la
masa fórmula relativa y la masa molar de KI, NaOH, CaO, ZnSO4 ,
CuSO4.5
H2O.
7.- Calcula la
cantidad de sustancia ( moles) de 10 g de Cu (sólido), 100 ml de H2O
(líquida), 32 g de NH3(gas) y 50 g de NaHCO3( sólido).
b.
Constante de Avogadro. Mol. Molaridad.
8.- Calcula el
número de iones en 30 g de CaF2, 50 g de Na2CO3
y 100 g de ZnSO4.
9.- Calcula el
número de iones que existen en 100 g de K Cl.
10.- ¿ En qué casos
se debe utilizar la expresión masa fórmula relativa en lugar de masa molecular
relativa?
11.- Indicar las
afirmaciones falsas . En 2 moles de HNO3 hay
12.- Indicar si
las siguientes afirmaciones son verdaderas o falsas.
-
a)
una disolución 1M de HCl es la que contiene 1 mol de HCl por cada litro
de agua.
-
b)
con dos moles de NaCl se pueden preparar 20 litros de disolución 0,2 M
-
c)
en 1 litro de disolución de H2SO4 0,5 M hay disueltos
98 g
-
d)
si 40 g de NaOH se disuelven en 1 litro de agua, la disolución es 1M.
13.- Calcula la
masa molecular relativa y la masa molar de H2O , Cl2,
HF , NH3.
14.- Calcula la
cantidad de sustancia ( moles) de 10 g de Cu (sólido), 100 ml de H2O
(líquida), 32 g de NH3(gas) y 50 g de NaHCO3( sólido).
15.- Calcula la
masa de 2 moles de átomos de oxígeno, de 3 moles de moléculas de oxígeno,
4 moles de unidades fórmula de CaCO3.
16.- Calcula la
masa en el SI de unidades de una molécula de nitrógeno, de un átomo de oxígeno,
y de una molécula de agua.
c). Cálculos
basados en las ecuaciones
17.- Sabemos que
el zinc metal reacciona con el ácido clorhídrico para producir cloruro de
zinc e hidrógeno gas. Si disponemos de 25 g de zinc, ¿qué volumen en de disolución
de ácido clorhídrico de concentración 3 Molar (2 mol/l) se necesita para que
todo el metal reaccione?
18.- Cuando se
calienta, el carbonato de cobre(II) descompone en oxido de cobre (II) y dióxido
carbono. Formula la ecuación de esta reacción
19.- El hierro
se obtiene por reducción del oxido de hierro, Fe203
(s), en un alto horno. El agente reductor es el monóxido de carbono, CO (g).
Calcula la masa de Fe (s) que puede obtenerse a partir de 1 tonelada de Fe203
(s), si el rendimiento del proceso es del 80%. La ecuación del proceso es:
Fe203
(s) + 3 CO (g)  2 Fe (s) + 3 C02
(g)
2 Fe (s) + 3 C02
(g)
20.- El hidrógeno
gas reacciona con oxígeno por encima de los 100oC para formar vapor
de agua de acuerdo con la ecuación:
2
H2(g) + O2(g)  2 H2O(g)
2 H2O(g)
Si todos los volúmenes
se miden a 110 oC y 1 atmósfera de presión, se puede esperar que:
-
a)
una disminución del volumen total después de la reacción
-
b)
que el volumen de vapor formado será igual al volumen de hidrógeno usado
-
c)
si se utilizan volúmenes iguales de hidrógeno y oxígeno para empezar la
reacción, un tercio del volumen final será de oxígeno sobrante.
-
d)
la masa de hidrógeno reaccionante es la mitad de la masa de oxígeno que
reacciona.
21.-
La reacción entre magnesio y un ácido diluido puede ser representada por la
ecuación iónica:
Mg(s)
+ 2 H+(ac)  Mg2+(ac) + H2(g)
Mg2+(ac) + H2(g)
De esto se puede
deducir que:
-
a)
1 mol de Mg necesita exactamente 2 moles de ácido sulfúrico H2SO4
para completar la reacción.
-
b)
1 mol de Mg necesita exactamente 2 moles de ácido clorhídrico para
completar la reacción.
-
c)
1 mol de Mg necesita exactamente 2 litros de ácido clorhídrico 1M para
completar la reacción.
-
d)
1 mol de Mg necesita exactamente 1 litro de ácido sulfúrico 2 M para
completar la reacción.
22.- Un agua oxigenada
de 20 volúmenes quiere decir que un litro produce 20 litros de oxígeno en
condiciones normales según la ecuación
2
H2O2  2 H2O + O2
2 H2O + O2
¿ Cuál es el valor
de molaridad de dicha agua oxigenada?
II.- La energía en las reacciones químicas
a) Energía calorífica. Exotérmicas
y Endotérmicas.
b) Energía eléctrica. Pilas y electrólisis.
1.- Reacción endotérmica entre cloruro de
tionilo y sulfato de cobalto.
Los dos productos se colocan en un vaso primero
adquiere un color rosa, posteriormente pasa a color azul y el recipiente queda
muy frío.
Procedimiento
-
a.
Hacerlo en un campana extractora
-
b.
Colocar unos 60 ml cloruro de tionilo en un vaso de 250 ml..
-
c.
Añadir 20 g de sulfato de cobalto .
-
d.
Agitar los dos reactivos mezclados. Notar que el color rosa cambia a color
azul.
-
e.
Se observa una reacción vigorosa con producción de un gas.
-
f.
Cuando la reacción ha terminado observar la disminución de la temperatura,
.
Los gases producidos en la reacción son primordialmente
de HCl y SO2
calor + CoSO4 7H2O(s) + 7 SOC12
 CoSO4(s)
+ 7 SO2(g) + 14 HCl(g)
CoSO4(s)
+ 7 SO2(g) + 14 HCl(g)
(rosa) (azul)
Esta
reacción endotérmica tiene una ventaja sobre otras y es que la temperatura
baja permanece durante unos 10 minutos.
Puede
producir hielo al colocar el vaso sobre una madera húmeda.
2.-
Dibujar el diagrama de energía para una reacción exotérmica y otro para una
reacción endotérmica.
3.-
Realizar la electrólisis en el voltámetro de Hoffman de una disolución concentrada
de carbonato o sulfato sódico y un indicador ácido-base. Se observa en el
ánodo desprendimiento de oxígeno y la disolución adquiere color ácido, y en
el cátodo desprendimiento de hidrógeno y color ácido.
4.-
Realizar la electrólisis del KI en un tubo en U. En el ánodo se produce iodo
y en cátodo se desprende hidrógeno y el carácter básico se detecta colocando
unas gotas de indicador en ese lado del tubo.
5.-
Se prepara una disolución de NaOH 0,1 M se electroliza durante 10 minutos
con electrodos de grafito. Se conecta un voltímetro y se observa la existencia
de una diferencia de potencial de lo que se denomina como pila de combustión.
III.-
Velocidad de las reacciones.
a) Su expresión.
b) Factores que influyen.
1.-
Efecto Autocatalítico
Cuando
a una solución incolora de 150 mL de ácido oxálico (8 g ácido oxálico en
500 ml de agua ) se añaden 50 ml de una solución púrpura de permanganato de
potasio (0.001 M Disolviendo 0.16 g de KMnO4 en 1itro) se vuelve
incoloro en varios minutos. Si embargo si se repite con unos cristales de
cloruro de manganeso que actúa de catalizador la reacción se produce en unos
30 s
Los
iones Mn2+ catalizan la reacción, en el primer caso es necesario
que se produzca un cierta cantidad de Mn2+, en el segundo caso
cuando se forma Mn2+el efecto autocatalizador se produce.
2
MnO4- + 5 C2O42- +
16 H+  2Mn2+
+ l0 CO2 + 8 H2O
2Mn2+
+ l0 CO2 + 8 H2O
2.-
Acción de un catalizador
-
a.
Coloca 200 ml de disolución de tartrato de sodio y potasio (12
g de KNaC4H4O6·4H2O con
200 ml agua destilada) en un vaso de 600 ml .
-
b.
Calentar la disolución hasta 70 °C .
-
c.
Añadir 80 ml de peróxido de hidrógeno .
-
d.
Añadir un pocos cristales de cloruro de cobalto(II) .
-
e.
Se produce una extensa emisión de burbujas, y notar la aparición de un complejo
activado de color verde.
Esta
reacción implica la oxidación del ácido tartárico, (HOOC-CH(OH)-CH(OH)-COOH),
por el peróxido de hidrógeno en presencia del cloruro de cobalto(II) como
catalizador.
El color
verde es debido a la formación del complejo activado tartrato de cobalto.
Notar
que el color original del cloruro de cobalto(II) es rosa.. Como el tartrato
es oxidado se rompe y se forma el cloruro de cobalto(II) inicial con lo que
el color rosa vuelve.
Oxígeno
y dióxido de carbono se producen y probablemente también ácido oxálico ,HOOC-COOH.
Esta
demostración es una de las pocas que permite observar realmente la formación
de un complejo activado y su acción .
No superar
los 70 °C, o la solución puede derramarse.
Esta
demostración es también un excelente método para mostrar la relación entre
la temperatura y la velocidad de reacción . Normalmente, una temperatura inicial
de 50, 60, o 70 °C producirá la reacción en 200, 90, o 40 s, respectivamente.
Como
regla general aumentando la temperatura en 10 °C la velocidad de reacción
se duplica.
3.-El
efecto de la superficie en la velocidad de reacción
Se necesitan
5 g de trozos de mármol, entre 0.5 cm y1.0 cm de diámetro, y la misma masa
finamente dividida. Montar el aparato de la figura
Recoger
los datos en la tabla
|
Mármol
en trozos
|
Mármol
pulverizado
|
| Tiempo
(minutos) |
Volumen ( ml) |
Tiempo
(minutos) |
Volumen
( ml)
|
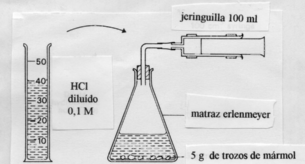
4.-Pesa
unos 5 g de trozos de mármol y colócalos en un matraz. Cierra el émbolo de
la jeringuilla hasta 10 cm3. Añade 40 cm3 de HCl 0.1
M , inmediatamente se conecta a la jeringuilla y se pone en marcha el reloj.
Toma la lectura del volumen cada medio minuto durante unos diez minutos y
anótalos en la tabla .
Repite
el experimento, esta vez usando la misma masa de mármol pero pulverizado.
-
 ¿ Qué forma
de mármol presenta la mayor superficie?
¿ Qué forma
de mármol presenta la mayor superficie?
-
¿
En qué caso la velocidad de la reacción es mayor?
-
¿Qué
gas se produce en la reacción?
-
¿
Cómo mediríamos la velocidad de reacción?
5.-
El efecto de la concentración en la velocidad de reacción
Necesitamos
el mismo aparato que en el experimento anterior .Pesar dos veces 5 g de trozos
de mármol finamente divididos. Para el primer experimento, usa 40 cm3
de 0.2 M de HCl. Para el segundo experimento usa 40 cm3 de 0.1
M de HCl, puede obtenerse diluyendo 20 cm3 de 0.2 M de ácido con
20 cm3 de agua (puede utilizar las lecturas obtenidas en el experimento anterior
para evitar hacerlo de nuevo)
Hacer
una tabla , y dibuja una gráfica con sus resultados . Basándose en el gráfico
, estima el tiempo necesario para producir 50 cm3 de gas , y expresa
la velocidad de reacción en cm3/min
IV.-
ÁCIDOS Y BASES
1.-Escribe
la ecuación ajustada de la reacción de neutralización entre ácido sulfúrico
e hidróxido de sodio.
2.-¿ Cuántos gramos de hidróxido de sodio reaccionan
con 100 ml de una disolución 0,5 M de ácido sulfúrico?
3.-Al disolver cloruro de hidrógeno en agua las moléculas de disocian produciendo
iones hidronio H3O+ según la ecuación
HCl + H2O  Cl- + H3O+
Cl- + H3O+
Si disponemos de 100 ml de una disolución 0,5 M ¿ Cuántos iones H3O+
habrá en la disolución ?
4.-Se disuelven 0,5 g de amoniaco en agua hasta obtener 500 ml de disolución.
Al disolver el amoniaco gas en agua de cada 100 moléculas de amoniaco 42
reaccionan con el agua según la ecuación:
NH3 + H2O  NH4+
+ OH-
NH4+
+ OH-
¿Cual es el número de OH-( iones hidróxido) por litro que hay
en la disolución?
5.-Indicar razonadamente el carácter ácido, básico o neutro de las siguientes
mezclas:
-
10 ml de HCl 0,1 M con 20
ml de NaOH 0,2 M
-
20 ml de H2SO4
0,1 M con 20 ml de KOH 0,2 M
-
50 ml de HCl 0,5 M con 25
ml de Ca(OH)2 0,2 M
6.-Analogías
y diferencia entre ácidos débiles y fuertes, pon un ejemplo de cada uno. Establecer
la diferencia entre un ácido fuerte diluido y otro ácido débil concentrado.
7.-Escribir la disociación iónica en la siguientes disoluciones acuosas:
ácido sulfúrico, ácido nítrico, ácido clorhídrico, hidróxido de sodio, hidróxido
de potasio, hidróxido de calcio, cloruro de cinc, carbonato de sodio, sulfato
de cobre (II), nitrato de plata, clorato potásico.
8.-Escribir la disociación iónica en la siguientes disoluciones acuosas:
ácido fosfórico, ácido perclórico, ácido nitroso, ácido sulfuroso, ácido
sulfhídrico, bromuro de plomo(II), hidróxido de bario, hidrogenocarbonato
de sodio, fosfato de niquel(III), hipoclorito de calcio.
![]() 2 Fe (s) + 3 C02
(g)
2 Fe (s) + 3 C02
(g)![]() 2 H2O(g)
2 H2O(g)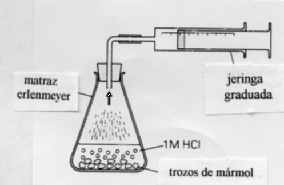
 ¿ Qué forma
de mármol presenta la mayor superficie?
¿ Qué forma
de mármol presenta la mayor superficie?