
NIVEL BÁSICO
1.-¿ Qué cambios de los siguientes son químicos?
a) hacer un jabón a partir de un aceite vegetal
b) hervir agua
c) quemar el gas natural
d) fabricar latas de aluminio a partir de metal aluminio.
e) hacer el café añadiendo agua al café en polvo
f) hacer un cristal a partir de arena
2.-¿ Qué cambios de los siguientes son físicos?
a) añadir agua a jugo de limón
b) quemar gasolina en un motor
c) obtener hiero de un mineral de hierro
d) obtener sal del agua de mar
3.-En las experiencias de laboratorio
¿ Qué observación te induce a pensar que ha ocurrido un cambio químico?
a) se produce un gas b) se produce un cambio de temperatura
c) tiene lugar un cambio de color d) se forma un sólido insoluble(un precipitado)
4.-Un gas incoloro, inodoro e insípido se piensa que es oxígeno. ¿Qué observación confirmaría esta suposición?
a) Se quema en el aire produciendo agua.
b) el gas apaga una llama.
c) enturbia el agua de cal.
d) una tablilla incandescente arde en el interior del gas.
5.-Se calienta una cinta de magnesio en el aire y se mide la masa del sólido antes de calentar (0,24 g) y después de calentar (0,4 g)
Explica estos resultados y escribe la reacción con palabras.
6.-¿ Qué ecuación no está ajustada?
a) 2 C + SiO2 ® Si + 2 CO
b) 2 Mg2Sn + 8 H2O ® 2 SnH4 + 4 Mg(OH)2
c) H3CBr + Mg ® H3CMgBr
d) 3 Pb + 8 HNO3 ® 3 Pb(NO3)2 + 3 NO + 4 H2O
e) 2 NaOH + Cl2 ® NaCl + NaClO + H2O
f) P4 + 3O2 ® P4O6
g) Cu(NO3)2 ® CuO + 2NO2 + O2
h) 2Al2O3 + 3C + 6Cl2 ® 4AlCl3 + 3CO2
i) 3PbO + 2NH3 ® 3Pb + N2 + 3H2O
7.-Ajusta las siguientes ecuaciones:
__H2SO4 + __NaOH ® __ H2O + Na2SO4
__ C3H8 + __ O2 ® __ CO2 + __ H2O + energía
Expresa con palabras las anteriores reacciones, indicando el tipo en la que la clasificarías
8.-La reacción de carbonato de magnesio con ácido clorhídrico diluido produce
a) CO2(g) y MgCl2(g) b) MgCl2(s) y Cl2(ac)
c) H2(g) y Mg(OH)2(s) d) Cl2(g) y MgO(s)
e) MgO(s) y CO2(g)
9.-Considerar la reacción Cu2S + O2 ® 2Cu + SO2. Sí 55.0 gramos de Cu2S se calientan
con exceso de oxígeno ¿ Qué masa de Cu se puede producir?
a) 43.9 g b) 2.0 g c) 18.5 d) 55.0 g
10.-Al añadir ácido clorhídrico sobre cinc se desprende hidrógeno. Explica ayudándote de dibujos como producirías dicha reacción y como identificarías el hidrógeno.
11.-Añade óxido de cobre a ácido sulfúrico templado y agitas, cuando no se disuelva más óxido filtra la mezcla, se evapora cuidadosamente el filtrado hasta la mitad del volumen original y se deja enfriar y cristaliza un sólido.
a) ¿ porqué puedes afirmar que se ha producido una reacción química?
b) ¿ qué sustancia que da en papel de filtro?
c) ¿ qué nombre tiene el sólido cristalizado?
12.-Ilustra con dibujos los siguientes pasos de una actividad en el laboratorio
I.- Coloca 10 ml de ácido sulfúrico en un matraz erlenmeyer
II.- Llena una bureta con una disolución de amoniaco. Añade 1 ml de esta disolución y agita la mezcla con una varilla de vidrio.
III.- Toma una gota de la disolución con la varilla y la pones sobre un papel de tornasol, repite el paso 2 y 3 hasta que papel adquiera el color azul
IV.- Vierte la solución en una cápsula de porcelana y evapora la disolución hasta un volumen mitad del inicial y lo dejas cristalizar ¿Cuál el nombre del compuesto formados?
13.- Comentar de forma razonada la veracidad o falsedad de las siguientes afirmaciones:
a) al descomponer por calentamiento el carbonato de calcio pierde masa
b) cuando un metal se oxida no varía su masa
c) cuando calentamos un trozo de cobre se recubre de una capa negruzca y su masa aumenta
d) en las reacciones el número de moléculas no varía
14.- Completar el siguiente cuadro
Ecuación |
Nombre de reactivos |
Nombre de productos |
Tipo |
2 KClO3(s) ® 2 KCl(s) + 3 O2(g) |
|||
Hg + S ® HgS |
|||
HCl(ac) + NaOH(ac) ® NaCl(ac) +H2O |
|||
2 H2(g) + O2 (g) ® 2 H2O(l) |
Breve elogio de la Química
En un debate entre directores de museos científicos europeos reunidos en Barcelona se elaboro un manifiesto dirigido a la ciudadanía:
1.- ¡ Tú eres química! Los seres vivos tienen entre otras cosas, un cuerpo material y la química se ocupa ,
justamente de la transformación de la materia. No existe el vis vitalis. Wholer , por ejemplo, sintetizó, en 1828 , la urea a partir del cianato amónico.
2.- ¡.... y también lo es el resto del universo ! La química tiene que ver con todas las ciencias que, de una forma u otra, versan sobre la materia, es decir , la química tiene que ver con todas las ciencias: física, biología , medicina, psiquiatría, farmacia, arqueología, geología, paleontología,
astronomía , astrofísica.....
3.- La química inventa nuevos materiales “ a la carta”. La historia de la civilización se puede escribir como la historia del dominio de la materia ( Edad de Piedra, Edad de Hierro, Edad de Bronce..). En un principio se trataba de elegir los materiales según sus propiedades así llamadas naturales. Hoy, la ciencia le ha dado la vuelta a esta situación. Puede arrancar de una lista de (anheladas) propiedades y buscar luego un material inexistente espontáneamente en la naturaleza, que las luzca ( plásticos, materiales con memoria de forma, ferrofluidos, semiconductores, superconductores, fluidos electrorreológicos, plasmas....)
4.- No existen copias mejores o peores de las moléculas, ¡ sólo existen ejemplares originales idénticos! No hay la menor diferencia entre una molécula de cloruro sódico a la deriva en el océano Índico y otra vibrando en la lágrima de un bebé.
5.- No existen sustancias tóxicas, ¡ sólo existen dosis tóxicas! Muchísima sal de mesa puede ser muchísimo peor que poquísimo cianuro. Los químicos pueden detectar cantidades inimaginablemente pequeñas de muchos compuestos. Eso es tranquilizador, aunque gracias a tal habilidad hoy sabemos, por ejemplo, que la contaminación ha alcanzado ya los paisajes más remotos del planeta.
6.- La química provee las soluciones a sus propios problemas. La presencia de una substancia repugnante o peligrosa en nuestro entorno acaso provenga de una reacción química. Es cierto, pero será sin duda otra reacción química la que nos libere de ella.
7.- Beethoven, Dante, Velázquez......, ¡ Lavoisier! Los grandes triunfos de la química, como la síntesis o la teoría de la estructura, son comparables a los más altos logros de la cultura humana.
8.- Ni siquiera los químicos son perfectos. En cuanto a los beneficios: existen sustancias que la química todavía no ha sabido reproducir, como la de los delicadísimos hilos de una tela de araña. En cuanto a los riesgos: tomar decisiones compete al ser humano que todo químico lleva dentro y, sobre todo, al químico que todo ciudadano moderno debería ir cultivando en su interior. Por ello, entre otras cosas , hay que amar la química
Actividades experimentales
1.-Añadir lentamente sosa al 10% sobre limaduras de aluminio, introducir el recipiente de la reacción en un cristalizador para añadir agua fría si la reacción se produce vivamente
2 NaOH(ac) + 2 Al + 2 H2O ® 2 NaAlO2(ac)+ 3 H2
2.-Efusión del hidrógeno a través de una hoja de filtro:
Se coloca un tubo de ensayo vertical con la abertura hacia arriba tapada con un papel de filtro, y sobre este coincidiendo las aberturas un tubo de ensayo con hidrógeno y posteriormente se da la vuelta y se produce la efusión que se puede comprobar explosionando el hidrógeno del tubo que inicialmente tenía aire.
3.-Producción de sulfuros metálicos colocando la mezcla en un ladrillo y se calienta en un punto con un bunsen.
Mg( 4,8 g) + S ( 6,4 g) ® MgS
2 Al ( 2,7 g) + 3 S ( 4,8 g) ® Al2S3
Zn ( 13 g) + S ( 6,5 g) ® ZnS
Fe ( 7 g) + S (4 g) ® FeS
Cu (4 g) + S ( 2 g) ® Cu2S- CuS
Pb ( 21 g) + S ( 3,2 g) ® PbS
Hg + S ® HgS reacción en frío
3.-Reacciones de descomposición endotérmica
El dicromato amónico de color naranja al calentar se convierte en Cr2O3 de color verde
El carbonato básico de cobre( malaquita) de color azul al calentar se convierte en CuO de color negro
El nitrato de plomo(II) blanco se convierte en amarillo emitiendo vapores rojizos de NO2
El nitrato de plata blanco, al calentarlo funde y pasa a amarillo, hierve pasando a pardo y por último pasa a negro emitiendo vapores rojizos de NO2
Si se recogen los vapores de NO2 sobre un tubo sumergido en agua con hielo se puede obtener líquido.
4.- La ameba de mercurio.
Coloca una pequeña porción de Hg (0,5 cm de diámetro) en un vidrio de reloj o cápsula de Petri, añadir HNO3 hasta cubrir el fondo y colocar unos pequeños cristales de K2Cr2O7 tocando al mercurio. Se produce una reacción redox en el que cambia la carga eléctrica en la superficie del mercurio con lo que cambia de forma
Hg ® Hg2+ + 2 e
Cr2O7 2- + 14 H+ + 6 e ® 2 Cr3+ + 7 H2O
5.- Reacción oscilante
Añadir 50 ml de H2SO4 a 450 ml de agua. Mientras se va agitando añadir 2 cucharillas de ácido malónico, 2 de bromato de potasio y un cuarto de sulfato de manganeso(II).
Se produce cambios oscilantes de incoloro a marrón , colores debidos a distintos estados de oxidación del manganeso
6.-Generación de gases a pequeña escala
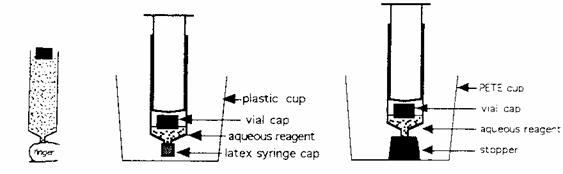
En 1992 Hubert Alyea publicó un método ingenioso para la obtención de gases de forma segura.
El método utiliza jeringuillas de plástico de 60 ml en las que se mezclan los dos reactivos.
El reactivo limitante se utiliza en forma sólida colocado en un pequeño tape de un frasco y el segundo reactivo se utiliza en disolución acuosa.
GAS |
Reactivo sólido |
Reactivo acuoso |
CO2 |
0,22 g NaHCO3 |
5 ml de vinagre o HCl 1M |
H2 |
0,03 g de Mg en polvo |
3- 5 ml HCl 1M |
O2 |
0,01 g de IK |
5 ml de H2O2 6% |
NH3 |
--------- |
3 ml de NH3 concentrado |
H2S |
0.22g de ZnS |
3- 5 ml HCl 1M |
Cl2 |
1 ml de HCl 6M |
3 ml de lejía |
SO2 |
2 g NaHSO3 |
5 ml HCl 1M |
a) Colocación del reactivo sólido
Se quita el embolo y se llena con agua colocando un dedo en el orificio pequeño para impedir que salga el agua, se coloca el reactivo sólido en el pequeño recipiente flotando en la superficie del agua, al retirar el dedo y vaciarse de agua el reactivo debe quedar en el fondo en el interior del pequeño recipiente.

b) Colocación del reactivo acuoso
Se coloca el embolo hasta que toque el recipiente que contiene el reactivo sólido. Se coloca el reactivo acuoso por aspiración dentro de la jeringuilla de forma que el recipiente con el sólido flote sobre la disolución.
c) Realizar la reacción
Se pone un tape de látex en orificio pequeño de la jeringuilla, y esta se coloca en un vaso de plástico que sirve de protección de posibles salpicaduras.
Manteniendo la jeringuilla y el vaso con la misma mano se agita para mezclar los reactivos, a veces es necesario ayudar al embolo a moverse mientras se desprende el gas.
Una vez obtenidos los 50 ml se coloca la jeringuilla con él embolo hacia abajo y él tape hacia arriba, con cuidado se quita él tape teniendo en cuenta que está bajo presión positiva, invertir la jeringuilla y descargar el exceso de líquido en el vaso.
Precaución: No quitar él tape con el extremo del tape hacia abajo pues él liquido saldrá pulverizado. Se puede adquirir práctica con la producción de dióxido de carbono.
Evitar el uso de ácidos minerales concentrados tales como sulfúrico, nítrico y clorhídrico.
Experimentos con dióxido de carbono
a) reacción con agua de cal: Se coloca un tubo de latex de unos 15 cm a la salida de la jeringuilla después de quitar él tape, se hace burbujear el gas sobre el agua de cal.
b) apagar la vela: sujetar una vela de cumpleaños a una varilla de vidrio, y se introduce en el interior de la jeringuilla que se mantiene con él embolo en la parte superior, después de haber quitado él embolo y maniendo él tape de látex.
c) el magnesio arde en dióxido de carbono: Se toma unos 10 cm de cinta de magnesio.
Mientras se mantiene la jeringuilla igual que en el apartado anterior se inicia la combustión en la llama de un mechero Bunsen , se introduce en el interior y el magnesio continua ardiendo produciendo unas cenizas que contienen MgO blanco y C negro.
2 Mg(s) + CO2(g) ® 2MgO(s) + C(s)