
NIVEL MEDIO
1.- La reacción 2 Na(s) + O2(g) ® Na2O2(s), es de
A. desplazamiento. B. descomposición. C. eliminación. D. síntesis. E. sustitución.
2.-Considerar la siguiente ecuación ajustada. 2H2 + O2 ® 2H2O ¿ Cuáles de las siguientes afirmaciones son falsas ?
a) una molécula de O2 reaccionará con 2 moléculas de H2.
b) un mol de O2 reaccionará con 2 moles de H2.
c) la reacción completa de 32.0 g de O2 producirá 2 moles de H2O.
d) la reacción completa de 2.0 g de H2 producirá 36.0 g de H2O.
e) la reacción que consume 32.0 g de O2 produce 36.0 g de H2O.
3.-Una muestra de metal Sr puro pesa 1.350 g se convierte en 1.597 g de SrO puro. Si la masa atómica del oxigeno es 16.0. ¿ Cuál es la masa atómica del estroncio?
A. 13.5 B. 16.0 C. 18.9 D. 87.4 E. 100.9
4.-La cal viva CaO, se disuelve en “ácido muriático” HCl, para formar CaCl2 y agua.
¿ Cuántos gramos de HCl se requieren para disolver 28.0 g de CaO? La ecuación de la reacción es
CaO + 2HCl ® CaCl2 + H2O
a) 3.65 g b) 18.2 g c) 43.0 g d) 56.0 g
5.-Ajusta la siguiente ecuación con los coeficientes enteros más bajos.
¿ Cuál es la suma de todos los coeficientes ?
I.- P4 + Cl2 ® PCl5
a) 7 b) 9 c) 11 d) 13 e)15
II.- ____PbO + ___NH3 ® ___Pb + ___N2 + ___H2O
a) 9 b) 15 c) 14 d) 12
a) 10 b) 12 c) 1 d) 16 e) 18
6.- Ajusta las siguientes ecuaciones y clasifícalas dentro de los tipos: síntesis, descomposición y doble descomposición.
CuSO4(ac) + Zn(s) ® Cu(s) + ZnSO4(ac)
HCl(g) + NH3(g) ® NH4Cl(s)
KClO3(s) ® KCl(s) + O2(g)
H2(g) + Cl2(g) ® HCl(g)
NaCl(s) + H2SO4(ac) ® HCl(g) + Na2SO4(ac)
7.-Si 50.0 g MgCO3 se convierte completamente en MgO por calentamiento. ¿ Cuál es la masa máxima de MgO producida?
(C 12.01, O 16.00, Mg 24.32)
a. 20.2 g b. 23.9 g c. 24.9 g d. 26.6 g e. 37.6 g
8.-Qué moles de amoniaco se necesitarán para producir 801moles de hidrogeno?
2 NH3(g) ® N2(g) + 3 H2(g)
a 2 mol b 22.4 mol c 267 mol d 534 mol e 1203 mol
9.-La ecuación
CH4(g) + 2 O2(g) ® CO2(g) + 2 H2O(g)
a) está ajustada.
b) es una reacción de combustión.
c) se producen 80 g de productos por cada 80 g de reactivos consumidos.
d) describe un cambio químico.
a, b y d a y b b y d todas
10.- Dada la reacción 2 KClO3 ® 2KCl + 3O2 ¿ Cuál es el número total de moles de KCl se producen cuando se descomponen 1,5 moles de clorato potásico?
11.-El conversor catalítico en un automóvil oxida el monóxido de carbón CO a dióxido de carbón CO2,
2CO(g) + O2(g) ® 2CO2(g)
¿ Cuántos litros de oxígeno se necesitan para oxidar 100 litros de monóxido de carbón a presión y temperatura constante?
a. 18 L b. 36 L c. 50 L d. 100 L e. 200 L
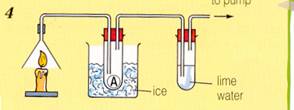
12.-Este aparato recoge los productos formados en la combustión de una vela
a) ¿qué se recoge en A?
b) ¿ qué sucede en el agua de cal y porqué ?

13.- Completa el cuadro que se refiere a tres experiencias de la siguiente reacción
CH4(g) + 2 O2(g) ® CO2(g) + 2 H2O(g)
1 mol |
|||
88 g |
|||
1010 moléculas |
14 .- Utilizando los modelos moleculares de líquidos y gases y los atómicos, iónicos de sólidos ( puedes utilizar la tabla de dicho modelos), representar las siguientes reacciones
a) 2 H2O(l) ® 2 H2(g) + O2(g) electrólisis del agua
b) 2 HgO (s) ® Hg(l) + O2(g)
c) Cl2(g) + 2 Na(s) ® 2 NaCl (s)
d) S(s) + O2(g) ® SO2(g)