1.- La constante de equilibrio de un proceso suma de otros dos es igual:
a) a la suma de sus constantes
b) al producto de sus constantes
c) a la diferencia de sus constantes
2.- En 2 moles de CO2 existen (siendo NA el número de Avogadro)
a) 6 NA átomos
b) 2 NA átomos
c) NA átomos
3.- Los compuestos CH3—CH2—CH2OH y HOCH2—CH2—CH3 son
a) isómeros
b) iguales
c) isótopos
4.- Sean para un proceso químico
Ea = energía de activación
Er = energía de los reactivos
Ep = energía de los productos.
Podemos decir que
a) la reacción es exotérmica si Ep<Er
b) Ea tiene un valor intermedio entre Er y Ep
c) Ea — Er es la energía desprendida
5.- ¿Cuál de las siguientes proposiciones es VERDADERA?
a) una disolución de ácido fuerte es siempre concentrada
b) una disolución saturada es siempre concentrada
e) una disolución diluida puede ser saturada
6.- ¿Cuál de las siguientes proposiciones es CORRECTA?
a) KMnO4 = manganato potásico
b) Ca(ClO)2 = hipoclorito cálcico
c) Al(NO2)3 = nitrato de aluminio
7.- ¿Cuál es, aproximadamente, la densidad del NH3 en condiciones normales?
a) 0’8 g/litro
b) 1 g/cm3
c) 17 g/litro
8.- En el Sistema Periódico, la primera serie de transición, desde el Se al Zn, está formada por elementos cuyos últimos electrones están en orbitales
a) 4d
b) 4p
c) 3d
9.- El primer valor de n (número cuántico principal) que puede tener orbitales d es
a) n = 3
b) n = 2
c) n = 4
10.- La presencia de un catalizador en el equilibrio
N2(g) + 3 H2(g) ↔ 2 NH3(g) ΔH= —22 Kcal
a) lo desplaza hacia la derecha
b) no influye
c) lo desplaza hacia la izquierda
11.- Cuando se pasa de CH3-CHOH-CH3 a CH3-CO-CH3 tiene lugar
a) una oxidación
b) una reducción
c) no hay ni oxidación ni reducción
12.- El índice o número de oxidación del uranio en UO22+ es
a) +2
b) +4
c) +6
13.- ¿Cuál es la sustancia que falta en el proceso H2SO4 + Cu → CuSO4 + H2O + … ?
a) OCu
b) H2
c) SO2
14.- La primera energía de ionización de un átomo M neutro (potencial de ionización) es la ΔH para el proceso
a) M(g) → M+(g) + e-
b) M(1) → M+(g) + e-
c) M+(g) → M2+(g) + e-
15.- Alcanzado un equilibrio químico, se añaden reactivos, sin variar la temperatura. ¿Qué le sucederá a Kc?
a) aumentará
b) disminuirá
c) no variará
16.- Cuando un alcohol secundario se oxida se produce
a) un aldehído
b) una cetona
c) un ácido
17.- Las especies químicas F- y Na+ tienen la misma distribución electrónica (1s2,2s2,2p6). ¿Cuál tendrá mayor volumen?
a) igual
b) Na+
c) F-
18.- ¿Qué grupo de elementos del Sistema Periódico tiene las energías o potenciales de ionización más elevados?
a) gases nobles
b) halógenos
c) alcalinos
19.- ¿Cuántos enlaces covalentes coordinados o dativos existen en :Ó:Cl:Ó:H ?
a) ninguno
b) uno
c) dos
20.- Tenemos volúmenes iguales de ácido clorhídrico, HC1, 0’1M y ácido acético, CH3—COOH, 0’l M. ¿Cuál de los dos precisa mayor cantidad de base para su neutralización?
a) el HC1
b) los dos igual
c) el CH3—COOH
21.- En la reacción 3 H2SO4 + 2 Al → A12(SO4)3 + 3 H2
a) no hay oxidación-reducción
b) se reduce el hidrógeno
c) se reduce el aluminio
22.- Para el proceso A(g) + B(g) → C(g), a temperatura ambiente
a) Kc = Kp
b) Kp > Kc
c) Kp < Kc
23.- En una molécula de NH3 hay
a) 3 átomos de hidrógeno
b) 3 moles de hidrógeno
c) 6’023•1023 átomos de nitrógeno
24.- El porcentaje de carbono en el benceno y en el acetileno o etino es
a) el mismo
b) mayor en el benceno
c) mayor en el acetileno
25.- El número de iones existentes en masas iguales de KC1 y KC1O3 es
a) igual en ambos casos
b) mayor en KC1
c) mayor en KC1O3
26.- ¿Cuál de las siguientes manifestaciones es VERDADERA?
a) Si dos muestras de los elementos A y B tienen iguales masas, tendrán el mismo número de átomos.
b) La masa atómica de un elemento es la masa en gramos de un átomo de dicho elemento.
c) El número de átomos en 5 g de O2 es igual al número de moléculas en 10 g de O2.
27.- ¿Cuál de las siguientes proposiciones es VERDADERA?
a) CH3-CHO = etanal
b) CH3-CO-CH3 propanal
c) CH3-CONH2 = etilamina
28.- Si la densidad de un gas, A, es doble que la de otro, B, a las mismas condiciones de presión y temperatura, podemos decir que
a) la masa molecular de B es doble que la de A
b) la masa molecular de A es doble que la de B
c) las masas moleculares no afectan a la densidad
29.- Sobre el propanal y la propanona, ¿cuál de las siguientes manifestaciones es
VERDADERA?
a) el propanal es un alcohol primario
b) la propanona, por oxidación, da ácido propanoico
c) son isómeros entre sí.
30.- Muchas reacciones, aparentemente sencillas, transcurren en realidad a través de varias etapas. Esto hace que la velocidad global esté fuertemente influenciada por la velocidad de aquéllas. Podemos decir que la velocidad del proceso global
a) es la suma de las velocidades de las etapas
b) depende fundamentalmente de la etapa más rápida
c) depende fundamentalmente de la etapa más lenta.
PROBLEMAS
PROBLEMA NÚM. 1
Un ácido orgánico dibásico contiene 40’7 % de carbono, 5’l % de hidrógeno y el resto de oxígeno. La sal monosódica anhidra del ácido contiene 16’4 % de sodio. Determinar la fórmula molecular del ácido y escribir su fórmula desarrollada.
C=12; O=16; H=l; Na23
PROBLEMA NÚM. 2
Una sustancia gaseosa se disocia según el equilibrio
A(g) ↔ B(g) + C(g).
En una experiencia, se introducen 0’20 moles de A en un recipiente vacío de 2 litros de capacidad, a 300 ºK. Cuando se ha alcanzado el equilibrio, la presión total es de 4’3 atm. Determinar, a dicha temperatura:
a) La presión inicial.
b) La constante Kc.
c) La constante Kp.
d) El porcentaje de disociación de A.
Dato: R = 0’082 atm•l/mol• K
PROBLEMA NÚM. 3
Una mezcla gaseosa contiene sólo nitrógeno (N2), oxígeno (O2) y anhídrido carbónico (CO2). El análisis elemental arroja un total de 65’2 % de oxígeno y 22’5 % de nitrógeno, en peso. ¿Cuál es la composición porcentual molar de la mezcla?
N=14, O=16; N=14
PROBLEMA NÚM. 4
Al añadir 5 gramos de sodio a abundante agua se liberan 39’29 KJ y al añadir 5 gramos de óxido de sodio, en las mismas condiciones, 21,32 KJ. Determinar el calor de formación del óxido sódico sabiendo que el del agua líquida es 285’91 KJ/mol.
Na=23, O=16
TERCER EJERCICIO
Consta de dos partes.
En la primera de ellas se te pide que hagas una serie de cálculos sobre datos de una curva de solubilidad frente a temperatura de una sal en forma hidratada y anhidra.
En la segunda, se pretende que determines la densidad y masa molecular del CO2 a partir de datos experimentales que se te facilitan.
PRIMERA PARTE
SOLUBILIDAD Y TEMPERATURA: SOBRESATURACIÓN
La solubilidad de las sustancias se representa habitualmente mediante curvas de solubilidad en una gráfica en la que en ordenadas figura dicha solubilidad, expresada en gramos de sal anhidra en 100 gramos de agua, y en abscisas se representa la temperatura en °C.

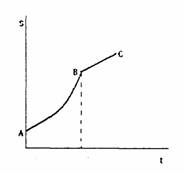
En la gráfica de la izquierda, se incluye la curva de una sustancia. Si partimos de una disolución de concentración y temperatura correspondiente al punto A y enfriamos lentamente, describiremos la línea horizontal AB (no cambia la concentración y disminuye la temperatura). Al intentar seguir enfriando a partir de B se nos depositará el soluto en exceso, pues se ha sobrepasado la curva de disolución saturada.
En algunos casos, al enfriar una disolución concentrada a elevada temperatura se puede sobrepasar la condición de disolución saturada sin que se produzca el depósito de la sal correspondiente: se alcanza así una situación inestable, sobresaturación, y basta agitar la disolución o incorporar unos pequeños cristales de la sal disuelta para que se deposite todo el exceso existente.
Algunas sustancias muestran una curva de solubilidad muy significativa, del tipo que se ve en la figura. La primera parte, AB, corresponde a la sal hidratada (por ejemplo, CH3—COONa.3H2O) y la segunda, BC, a la sal anhidra (CH3—COONa). La temperatura correspondiente al punto B es la de transformación de sal hidratada en sal anhidra: por debajo de esa temperatura, la fase sólida estable en contacto con la disolución saturada es la sal hidratada y, por encima, es la sal anhidra.
* * *
En la gráfica de la página siguiente se representa la curva de solubilidad del sistema CH3—COONa.3H2O/CH3—COONa. La línea de trazos, BD, corresponde a la curva de solubilidad del acetato anhidro por debajo del punto de transición, la cual puede obtenerse debido a la dificultad o retraso en la transformación de sal anhidra en sal hidratada.
1.- Determinar en la gráfica la temperatura de transformación de sal anhidra en sal hidratada.
2.-Preparamos una disolución de 125 gramos de sal anhidra en 100 gramos de agua, a 65 ºC.
2a) Representar en la gráfica un punto, P, correspondiente a esta disolución.
2b) Enfriando lentamente y sin agitación alcanzamos los 0 °C. ¿Cuántos gramos de sal en forma anhidra se depositarán?

3 .- Preparamos otra disolución de 110 gramos de sal anhidra en 100 gramos de agua, a 70 °C.
3a) Representar en la gráfica un punto, Q, correspondiente a esta disolución inicial.
3b) Enfriando muy lentamente y sin agitar alcanzamos los 20 °C, momento en el que echamos unos pequeños cristales de sal trihidratada. ¿Cuántos gramos de acetato sódico trihidratado se separarán?
DATOS: C = 12; H = l; O = 16; Na = 23
AYUDA: Hay que tener en cuenta que el sólido depositado arrastra parte del agua y en la disolución no quedarán los 100 gramos de agua que había inicialmente. Los pasos que tienes que realizar son:
• Llamar x a los gramos de trihidrato que se depositan.
• Determinar, en función de x, los gramos de sal anhidra y de agua que contienen.
• Leer en la gráfica los gramos de sal anhidra que deben quedar por 100 gramos de agua a la temperatura de 20 °C.
A partir de este dato, hallar los gramos de agua que quedan realmente en la disolución (en función de x)
SEGUNDA PARTE
DETERMINACiÓN DE LA DENSIDAD DE UN GAS Y DE SU MASA MOLECULAR
Como sabes, cuando una masa determinada de gas (considerado perfecto) está en dos condiciones distintas se cumple:![]() siendo P y P´ las presiones, V y V’ los
siendo P y P´ las presiones, V y V’ los
volúmenes y T y T’ las temperaturas absolutas, en cada una de las condiciones.
Puede demostrarse que la variación de la densidad de un gas con la presión y la
temperatura viene dada por ![]() = , siendo d y d’ las densidades en cada una de las condiciones.
= , siendo d y d’ las densidades en cada una de las condiciones.
¿Sabrías deducir esta última expresión?
Hecha esta aclaración, pasamos a los datos experimentales:
Masa de un matraz de vidrio lleno de aire, a 20 °C y 750 mm de Hg: 74’686 g.
Masa del matraz lleno de agua a 20°C: 399’70 g.
Masa del matraz lleno de CO2 a 20 °C y 750 mm de Hg: 74’890 g
Densidad del aire en condiciones normales: 0’00129 g/cm3.
Densidad del agua a 20 °C: 0’9982 g/cm3.
R = 0’0082 atm.litro/mol.K
Determinar la densidad del CO2 en condiciones normales y su masa molecular: