Las Biomoléculas
Son compuestos orgánicos de C:
-Existe una simplicidad fundamental:la forman unas pocas moléculas sencillas
-Economía molecular: sin despilfarros
-La identidad de las especies está garantizada por el conjunto de proteínas y ácidos nucléicos que los forman.
-Mantienen una ordenación secuencial desordenando el medio ambiente
-Las células actúan como máquinas vivas
Grupos funcionales
1.Inorgánicas
EL AGUA-.Es una de las moléculas más abundantes de la tierra, cubre la mayor parte de su superficie y está presente en todos los seres vivos en grandes proporciones. Ejercicios
La vida además, se supone que surgió del agua y por ello los seres la incluyen en su composición.
Los únicos seres vivos que la tienen en pequeñas cantidades, son las semillas, debido a su aletargamiento. Para salir de él, precisan gran cantidad de agua.
La existencia de dos enlaces covalentes con H, hace que la molécula sea bipolar, debido a la atracción muy fuerte del núcleo de oxígeno por los e-, que hace que estos permanezcan más tiempo en torno al núcleo de O, con lo que la región próxima a cada núcleo de H es débilmente positiva.
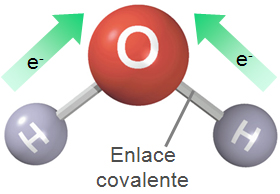
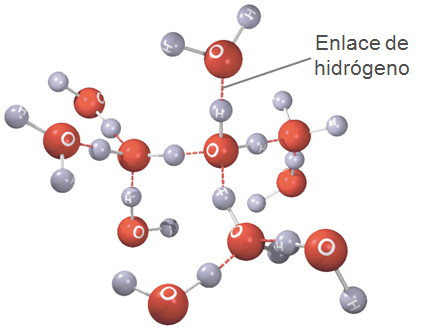
El átomo de O además posee 4 e- adicionales apareados en dos orbitales, débilmente negativos. La molécula tiene 4 vértices, dos con carga positiva y dos negativa. La F de atracción entre estas cargas contrarias, hace que queden unidas por puentes de H, en que los enlaces O-H, guardan una relación de 140º(aunque estos enlaces son mucho más débiles, pero en conjunto poseen una fuerza considerable..Así en los cristales de hielo, cada molécula de agua forma enlaces de H con otras tantas moléculas de agua, estando las moléculas más separadas entre sí que en el agua líquida; por esto el hielo flota en el agua. En estado vapor, la disposición de las moléculas es más desordenada, y los enlaces se rompen y crean continuamente.
PROPIEDADES
-1.-EL AGUA ES UN DISOLVENTE.(Solución es una mezcla uniforme de moléculas de dos o más sustancias). La mayoría de las moléculas se disuelven en agua mejor que en otro disolvente. Debido a la naturaleza polar de la molécula, el agua disuelve fácilmente las sustancias polares y las iónicas : las moléculas de agua se aglomeran alrededor de los iones cargados y los separan. Las sustancias que se disuelven en agua se denominan polares o hidrofílicas. Las moléculas que carecen de regiones polares, como las grasas tienden a ser muy insolubles en agua. Son sustancias hidrófobas.
Grupos polares: -OH, -COOH, -C=O
Grupos apolares : radicales alquilo, fenilo, etilénico..
CONSECUENCIAS: Esto permite que en el agua se realicen la mayor parte de las reacciones químicas de las células. Además es un buen vehículo de transporte de sustancias dentro del organismo y en los intercambios con el medio (bebemos agua y excretamos agua.
2.-COHESIÓN Y ADHESIÓN DE LAS MOLECULAS DE AGUA.
Cohesión es la capacidad de mantenerse juntas sustancias iguales. Las moléculas de agua, gracias a sus enlaces de hidrógeno, poseen mayor cohesión que cualquier otro líquido. (formación de superficie convexa en borde de vaso de agua, o capacidad de los "zapateros" de andar por encima del agua.) Ello implica que el agua sea prácticamente incompresible. Esto le confiere la propiedad de proporcionar rigidez y turgencia a las células Función estructural) .También que el agua tenga una gran tensión superficial
Adhesión es la capacidad de mantenerse juntas sustancias diferentes. El agua, por su naturaleza polar, puede unirse a superficies cargadas, lo que explica su gran capilaridad, o capacidad para ascender por los poros del suelo o de una hoja.

3.-EL AGUA POSEE UN ALTO CALOR ESPECIFICO.
Requiere mucho calor para elevar la Tª del agua. Al bajarla se desprende también mucho calor. El gran calor específico es consecuencia de los enlaces de H ya que estos tienden a restringir el movimiento de de las moléculas. En comparación con el aire, el agua se calienta mucho menos en verano y se enfría mucho en invierno.
Gracias a esta capacidad para absorber el calor producido en las reacciones metabólicas y al gran contenido en agua de plantas y animales, la Tª de los seres vivos puede mantenerse sin grandes oscilaciones. Esto es importante ya que las reacciones Qª de importancia biológica sólo ocurren en estrechas gamas de Tª. Los organismos que viven en océanos o grandes extensiones de agua dulce, están en ambientes con Tª relativamente constante.
4.-ALTA CONDUCTIVIDAD TÉRMICA
El calor producido en una región del cuerpo es rápidamente distribuido por él, impidiendo la existencia de puntos calientes
5.-ALTO CALOR DE VAPORIZACIÓN
Necesita mucho calor para transformarse en vapor, ya que habría que conseguir romper todos los puentes de H.Esto les sirve para regular su Tª, ya que al evaporarse el agua(por el sudor o el jadeo de animales)la Tª corporal disminuye.
6.-LA DENSIDAD DEL AGUA AUMENTA A LOS 4ºC.
El hielo, al ser menos denso que el agua, flota, lo que supone una ventaja para los organismos acuáticos de regiones frías. Forma una capa que aísla el agua del frío exterior y retarda la formación de más hielo, protegiendo de la congelación.
Sin embargo la formación de cristales de hielo dentro de un organismo puede destruir sus células. Así determinados animales poseen anticongelantes naturales, como el glicerol. En plantas existen tejidos resistentes a los cristales, mientras que los seres vivos que carecen de adaptaciones han de invernar.
SALES MINERALES.
Son componentes esenciales.
De dos tipos:
-Insolubles, con función esquelética, como los carbonatos y fosfatos, que forman parte de los esqueletos y conchas. El fosfato cálcico contribuye al endurecimiento de los huesos y la sílice endurece plantas y diatomeas.
-Solubles:
*Cationes: Na, Ca, K, Mg
*Aniones: Cl, SO4, CO3, CO3H, PO4, PO4H, PO4H2..
Cada uno de estos iones cumple una función determinada, que puede ser también antagónica:
-El Ca activa la contracción muscular y el Mg la inhibe
Funciones:
-Mantienen un grado de salinidad constante.
-Regulan el pH, debido a que al ionizarse en mayor o menor grado pueden contrarrestar el efecto de ácidos o bases añadidos. Es el efecto tampón
-Funciones osmóticas .La ósmosis es un fenómeno que se produce cuando dos disoluciones de distinta concentración están separadas por una membrana semipermeable que permite el paso de disolvente, pero nada o casi nada del soluto.
Si la concentración es mayor en el exterior que en el interior de la célula (medio hipertónico) el agua tenderá a salir. En vegetales se produce la plasmolisis.
Si la concentración es mayor en el interior que en el exterior, se produce la turgescencia. Las células animales sin refuerzo de la pared celular pueden sufrir también la lisis.
Esto explica muchas de las propiedades de los seres vivos:
-Las raíces absorben agua
-Los protozoos tienen una vacuola contráctil para bombear el exceso de agua que absorben
-El crecimiento rápido de plantas se debe a la turgescencia
-Las inyecciones intravenosas han de tener la misma presión osmótica que el plasma.
DISOCIACION DE LAS MOLECULAS Y pH
Muchas sustancias, cuando se disuelven an agua, se disocian en iones. Algunos lo hacen totalmente mientreas que en otras sólo se disocian parte de sus moléculas, de forma que en la solución algunas permanecen intactas y otras ionizadas.
La molécula de agua se disocia parcialmente en H+ y OH-
| H2O | H+ + OH- |
Se cumple que [H]×[OH] = 1,0×10-14
[H] = [OH] = 1,0× 10-7
Según su modo de disociación las moléculas se clasifican en ácidos, bases o sales.
-El ácido libera H+ cuando se disocia en agua.
-La base es una sustancia que al disociarse, libera OH- o acepta H+
-¿Cómo sería el agua?
-Una sal es una sustancia en la que el H+ de un ácido se ha sustituido por un ión positivo.Se disocian en el anión y catión correspondiente.
| NaCl | Na + Cl |
El grado de acidez o basicidad de una disolución se expresa mediante su valor de pH
La mayoría de las reacciones químicas que ocurren en los seres vivos requieren un pH constante y próximo a 7.Nuestra sangre y la mayor parte de los fluidos corporales tienen un pH de 7.4.Los enzimas que catalizan las reacciones celulares funcionan únicamente dentro de unos límites de pH, existiendo un pH óptimo.
Si al agua pura le añadimos un ácido o una base el pH cambia rápidamente.Sin embargo, si añadimos lo mismo a la sangre, no varía apenas.Esto se debe a que las células y fluidos corporales contienen unas sustancias amortiguadoras, llamadas tampones que mantienen constante el pH, evitando el exceso de H+ o de OH-.
| Exceso H+ + HCO3- | H2CO3 |
H2O + CO2 |
Exceso OH- + HCO3- ------------- CO32- + H2
LOS ESTADOS DE LA MATERIA VIVA
Los seres vivos están formados por sustancias en estado sólido, líquido y gaseoso.
En estado sólido, aquellas sustancias que constituyen elementos esqueléticos y de protección, como huesos, depósitos de lípidos, pelos, plumas...
Pueden ser de dos tipos;
-Inorgánicas, fosfato cálcico, carbonato...
-Orgánicas, como colágeno, almidón, queratina, sebo, exosqueleto