
Proteínas
Todas las proteínas están formadas por Aminoácidos
•Son moléculas pequeñas, monómeros de los péptidos y las proteínas.
•Son cristalinos, casi todos dulces y presentan isomería, ya que poseen un carbono unido a cuatro radicales distintos (excepto en el caso de la Glicocola). Por ello, es un carbono asimétrico. Uno de esos radicales siempre es un grupo ácido (carboxilo) y el otro es básico (amina). El tercer grupo es un Hidrógeno y el cuarto es un radical, característico de cada aminoácido. |
Estos son los distintos Aminoácidos que las constituyen.
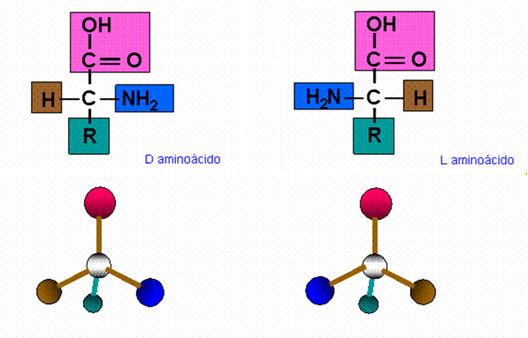
Estereoisomería
En todos los aminoácidos biológicos, excepto en la glicocola, el C alfa es asimétrico, por lo que hay una forma D o una forma L (igual que en los monosacáridos)
Propiedades químicas
•Los aminoácidos presentan cargas. Los aminoácidos pueden captar o ceder protones al medio, dependiendo del pH de la disolución en la que se encuentren. Si la disolución es ácida, los aminoácidos captan protones y se comportan como una base. Si la disolución es básica, ceden protones y se comportan como un ácido. Por tener este comportamiento, se dice que los aminoácidos son anfóteros.
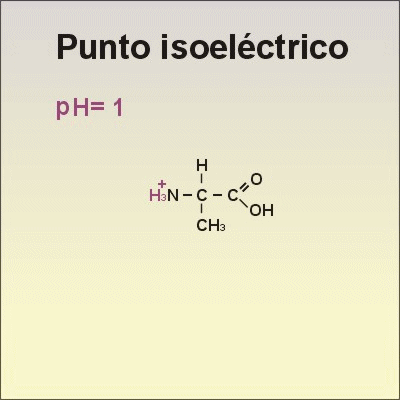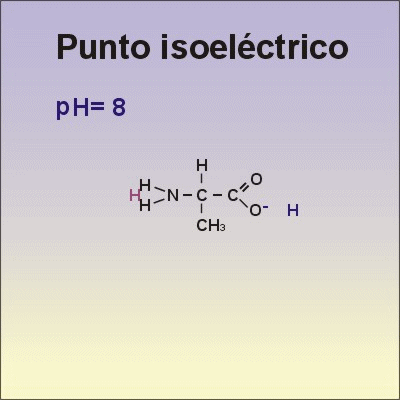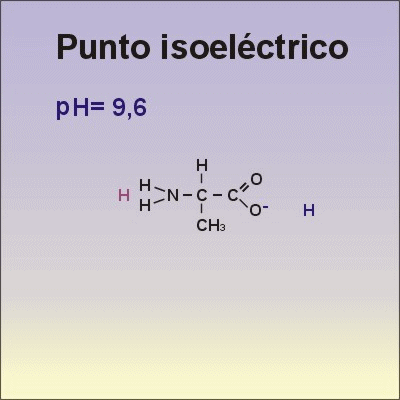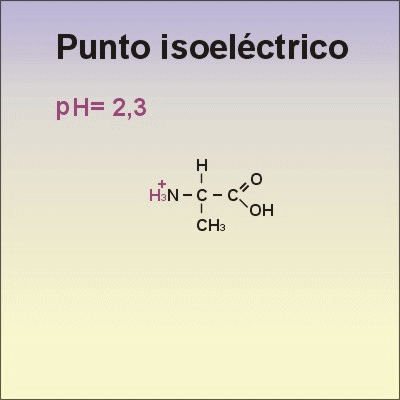
•El punto isoeléctrico es el valor de pH al que el aminoácido presenta una carga neta igual al cero.
•Observa qué le ocurre al aminoácido Alanina cuando cambia el pH, en la animación de la derecha.→ |
 |
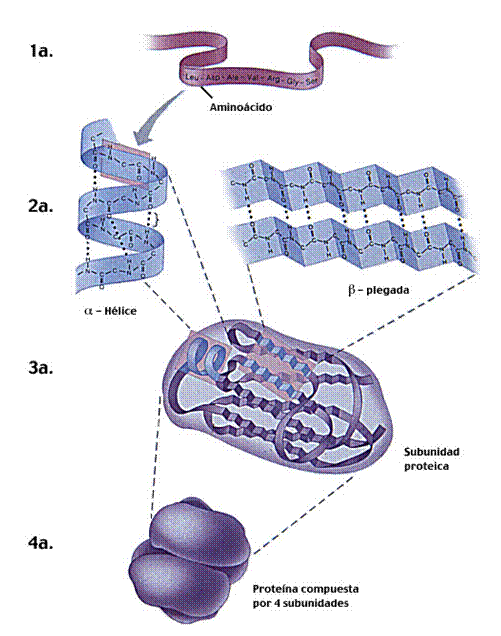
ESTRUCTURA O CONFORMACIÓN DE LAS PROTEÍNAS
La conformación de una proteína es la disposición espacial que adopta la molécula proteica. Las cadenas peptídicas, en condiciones normales de pH y temperatura, poseen solamente una conformación y ésta es la responsable de las importantes funciones que realizan.
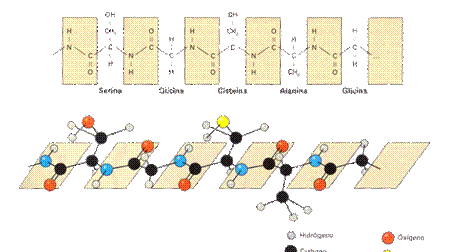
Estructura primaria: formada por la secuencia de Aminoácidos unidos entre sí
La estructura primaria se sustenta en la formación de enlaces peptídicos entre los aminoácidos que la forman:

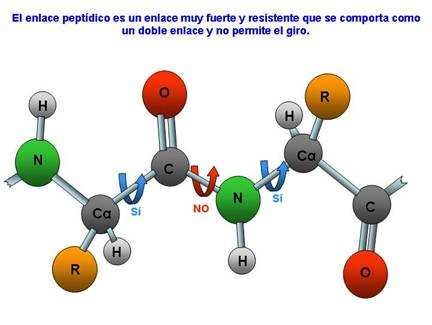
Los átomos unidos al carbono y al nitrógeno que forman el enlace peptídico, están todos en el mismo plano
Todas las proteínas están formadas por combinaciones de los 20 tipos de aminoácidos
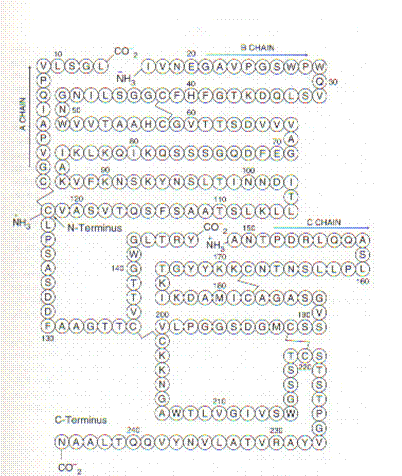
Ejemplo: Estructura primaria de la a-quimiotripsina. Esta proteína es una enzima que consta de tres cadenas unidas mediantes puentes disulfuro.
 http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B1_BIOQUIMICA/t15_PROTEINAS/informacion.htm
http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B1_BIOQUIMICA/t15_PROTEINAS/informacion.htm
La cadena polipeptídica no es rígida sino flexible, debido a la rotación de los enlaces de sus Aa, a excepción del peptídico. Esto permite la aproximacion de átomos que se encuentran alejados en la estructura primaria, de lo que resulta una ordenación tridimensional.
Se denominan conformaciones a las posibles formas diferentes que puede adoptar una proteína a causa de la ordenación espacial de sus átomos.
En un medio acuoso, los Aa con cadenas laterales apolares tienden a orientarse en el centro de la molécua para evitar el contacto con el agua.
-Los grupos polares suelen interaccionar con puentes de H.
-Se pueden formar enlaces disulfuros entre dos Cys.
La hélice alfa: esta hélice mantiene su forma por la presencia de los puentes de hidrógeno, indicados por las líneas de puntos.Es dextrógira.similar a un cilindro: la cadena principal estrechamente arrollada, forma la parte interior del cilindro (se estabiliza por puentes de H)y las cadenas laterales se extienden hacia afuera en una disposición helicoidal. 3,6 Aa/vuelta.Frecuente en proteínas fibrosas.
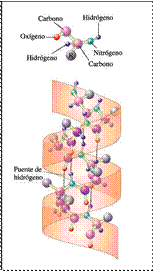
-β-lámina plegada: consiste en una hoja en vez de un cilindro .Queda estabilizada por puentes de H entre cadenas laterales distintas, produciéndose la interacción entre polipéptidos en paralelo o en antiparalelo.Los R hacia arriba o hacia abajo.Se vió en la fibroína.Es frecuente en globulares
Los pliegues se forman por la existencia de puentes de hidrógeno entre distintos átomos del esqueleto del polipéptido 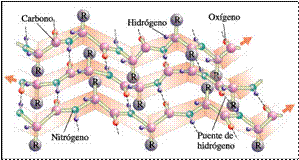
Hélice de colágeno
-Colágeno: restos de Pro e OH-Pro voluminosos que no forman puentes de H, y se alternan con glicinas (muy pequeñas) que constituyen un tercio de los Aa.Cada una de las tres cadenas polipeptídicas está en una conformación helicoidal, arrollándose los tres sobre si mismos para formar un cable rígido : se necesita una fuerza de 10 Kg para romper una fibra de 1 mm.Los tres filamentos se unen mediante puentes de H , con 3,3 Aa/ vuelta. Esto provoca una unión, más laxa.Es la proteína más abundante en los mamíferos, constituyendo la cuarta parte: piel, huesos, tendones, cartílagos, vasos sanguíneos y dientes.
•Es una estructura helicoidal, formada por hélices más abiertas y rígidas que en la estructura de a-hélice. Esto es debido a la existencia de gran número de aminoácidos Prolina e Hidroxiprolina. Estos aminoácidos tienen una estructura ciclada, en forma de anillo, formando una estructura, también rígida, en el carbono asimétrico, lo que le imposibilita girar. |
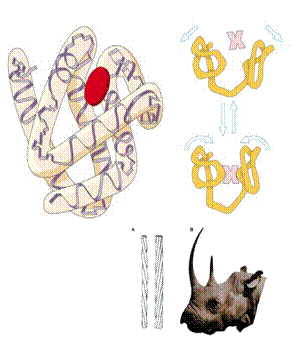
•La estructura terciaria es la forma que manifiesta en el espacio una proteína. Depende de la estructura de los niveles de organización inferiores.
–Puede ser una conformación redondeada y compacta, adquiriendo un aspecto globular. Suelen ser de transporte
–También puede ser una estructura fibrosa y alargada. La conformación espacial de la proteína condiciona su función biológica: resisten tensión |
 |
Informa sobre las interacciones entre distintas regiones de la cadena: Aa muy separados en la secuencia lineal.La estructura secundaria se pliega hasta formar la proteína.
Enlaces:
-Iónicos entre los grupos R con distinta carga y puentes de H
-Disulfuro
-Interacciones hidrofóbicas debido a la tendencia de los grupos apolares a permanecer juntos para evitar el contacto con el agua. Generalmente la estructura terciaria de una proteína incluye regiones con estructura en hélice-α (se representan con una hélice), β (con una flecha)e incluso al azar
Hay dos tipos de estructuras:
1-Activa: globulares, que desempeñan funciones celulares y reconocen ligandos a los que se pueden unir.
2-No activas: fibrosas, con función estructural.
La existencia de enlaces que permiten la rotación de sus átomos, posibilita que cualquier proteína adopte gran nº de formas : la mayoría adopta una única conformación,por interacciones débiles entre cadenas laterales,
-Nos indica la conformación global,Coexisten las dos conformaciones secundarias:
-Aa como Pro e OH-Pro interrumpen la α-hélice
-Los restos R hidrófobos tienden a alejarse replegándose la estructura para alejarse del agua.
-Los restos de Cys forman puentes di-S
-El Ph provoca cambios.Así la misma secuencia inicial puede provocar distintas conformaciones
+Filamentosa.- mantienen la estructura secundaria alargada y retorcida.Normalmente formadas por hélice-α
Insoluble en sales y agua
β-queratina y colágeno
Forman superhélices, tipo a la elastina
+Globular.-Se pliega la estructura secundaria hasta formar casi un ovillo.Soluble en agua y sal, y se difunden.En los tramos rectos tiene forma de α-hélice y en los codos, de lámina β.La estabilidad la deben a:
-Puentes de H entre átomos vecinos : C=O y N-H
-Enlaces electrostáticos: NH3+ y COO-
-Fuerzas de Van del Waals: debido a la presencia de radicales aromáticos.
-Puentes disulfuro entre restos de Cys.
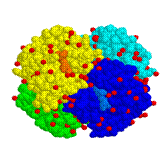 |
En este tipo de estructura se unen varias cadenas polipeptídicas entre sí, a cada una de estas cadenas polipeptídicas se le llama protómero -la hemoglobina por ejemplo tiene cuatro protómeros-. |
Para ser funcional requiere la asociación de varias cadenas polipeptídicas o subunidades.Las subunidades se mantienen unidas por enlaces de hidrógeno, interacciones hidrofóbicas o enlaces disulfuro.Las subunidades pueden ser iguales o distinta, existiendo numerosos representantes de cada tipo.
Ejemplos
La ferritina está formada por 20 subunidades idénticas.La insulina por 2 y la hemoglobina por 4, iguales dos a dos. Ciertas estructuras celulares están constituidas por agregados de proteínas idénticas, con capacidad de unirse consigo mismo formando estructuras geométricas.Triple hélice de colágeno formada por la asociación de 3 cadenas idénticas.El filamento de actina formado por 2 cadenas enrolladas en hélice.También los microtúbulos son estructuras cuaternarias de una proteína, la tubulina |
|
•Se trata de una proteína citotóxica aislada de Aspergillus giganteus. Consta de una única cadena polipeptídica compuesta por 150 aminoácidos. Esta proteína es una ribonucleasa muy específica que inactiva los ribosomas eucarióticos e inhibe el crecimiento de varias líneas celulares procedentes de tumores humanos. Se han producido diferentes formas mutantes de esta proteína, al objeto de estudiar tanto su actividad enzimática como su capacidad para interaccionar con membranas biológicas. |
Funciones de las proteinas
•Función hormonal: algunas proteínas funcionan como mensajeros de señales hormonales, generando una respuesta en los órganos blanco.
- Función catalizadora. Las enzimas funcionan como biocatalizadores, ya que controlan las reacciones metabólicas, disminuyendo la energía de activación de estas reacciones

- Otras funciones.La monelina, proteína de una planta africana, se está estudiando como edulcorante alimentario no tóxico y que no produce obesidad.El plasma de algunos peces del Antártico contiene proteínas anticongelantes que protegen a la congelación.
Propiedades
•Desnaturalización: la conformación de una proteína depende del pH y de la temperatura de la disolución en la que se encuentre. Cambiando estas condiciones, también puede cambiar la estructura de la proteína. Esta pérdida de la conformación estructural natural se denomina desnaturalización. El cambio de pH produce cambios en las interacciones electrostáticas entre las cargas de los radicales de los aminoácidos. La modificación de la temperatura puede romper puentes de Hidrógeno o facilitar su formación. Si el cambio de estructura es reversible, el proceso se llama renaturalización.
Se consigue ruptura de puentes de H, puentes diS, que son interacciones débiles, por lo que se deshace la estructura 2ª, 3ª y 4ª, se convierten en filamentos lineales que se entrelazan hasta formar compuestos fibrosos e insolubles en agua.
-Si las condiciones ambientales que provocan la desnaturalización fueran poco, o son débiles, se dice que ésta es temporal y reversible.Así al realizar una permanente, estamos rompiendo enlaces de H y formando otros nuevos, condición que cesa.Cuando cesan las condiciones, se pliega y adopta la configuración original: LA FORMA DE UNA PROTEÍNA NO ES MAS QUE LA CONFORMACIÓN MAS PROBABLE Y ESTABLE Y DEPENDE DE LAS SECUENCIAS DE Aa Y DEL MEDIO.
-Si los cambios son intensos : no se recupera y es irreversible: albúmina de huevo --------- fibrosa, insoluble globular, soluble
Si la Tª es mayor de 60º, se rompe la estructura helicoidal
- CAPACIDAD AMORTIGUADORA: gracias a la capacidad anfótera de los aminoácidos.
Datos moleculares de algunas proteínas |
Masa molecular Nº de Nº cadenas |
Insulina 5.733 51 2 |