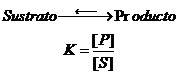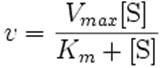Los enzimas
-Cada reacción metabólica tiene su catalizado o enzima. En general. Son sustancias que aceleran las reacciones químicas porque disminuyen la energía de activación de la reacción.
-En las reacciones acopladas, una misma enzima cataliza las dos reacciones a la vez.
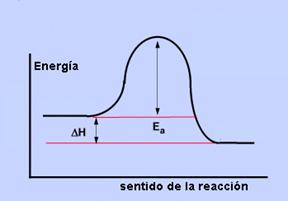
En toda reacción química es necesaria la aportación de una energía inicial o de activación para que se inicie la reacción, independientemente de que la reacción sea espontánea y vaya acompañada de una liberación de energía en forma de calor (exotérmica) o de absorción de calor(endotérmica)
En general todas las reacciones metabólicas están regulas por los enzimas, unas proteínas globulares que actúan como catalizadores, aumentando la velocidad de aquellas reacciones que son energéticamente posibles. Las enzimas permiten las reacciones en las condiciones de Tª. P y pH propios del medio intracelular, reduciendo la energía de activación necesaria para que se produzca la reacción.
1.-Definición.
-Los enzimas ejercen su acción biológica uniéndose selectivamente a determinadas moléculas: SUSTRATOS
-Inducen modificaciones químicas en los sustratos por ruptura, formación o redistribución de sus enlaces covalentes o por introducción o pérdida de grupos funcionales.
-Son biocatalizadores de las reacciones que constituyen el metabolismo
S + E -------P
-Intervienen a concentraciones muy bajas
Aceleran las reacciones sin sufrir modificaciones.
ENERGÍA Y REACCIONES QUÍMICAS
TIPOS DE REACCIONES
1.-EXERGóNICAS O EXOTÉRMICAS.-las moléculas que van a reaccionar poseen una energía interna mayor que los productos que se desprenden de la misma : se libera energía
|
| AB -Transcurren de forma espontánea
|----- (ej. agua de un depósito en el
| tejado, a cualquier piso)
| A+B
| -----
|
|_______________________
Reacción
2.-ENDERGONICAS O ENDOTERMICAS: es necesaria la aportación de energía.Los reactivos tienen menor energía que los productos que se aporta en forma de nuevos enlaces.
Energía
|
| CD -Transcurren de forma no espontánea
| ----- (ej. agua de un depósito en el
| sótano a cualquier piso)
|C+D
|---- |
|_______________________
Reacción
En las células:
Se producen ambas de forma espontánea, son Reacciones acopladas.
La reacción endergónica, no espontánea, se asocia a la exergónica, en la que se produce el paso de ATP a ADP.
El ATP es una molécula móvil que actúa como transportadora de energía química.
Si el P se une a moléculas orgánicas P! y es un enlace rico en energía
Cuando en la célula se producen exergónicas (de degradación) la energía liberada es aprovechada por el ADP que lo acumula en forma de ATP.
AB --------------------A + B
ADP + Pi ATP
CD¬--------------------C+D
La espontaneidad no es inmediata: Ninguna reacción se produce de forma espontánea, sin aporte de energía previo, necesario para que se inicie la reacción.
Las moléculas que reaccionarán deben alcanzar el estado de transición: activación transitoria, deben " animarse" para colisionar y poder reaccionar.
Estas energías que requieren es la energía de activación: a menor energía de activación, más fácilmente se produce la reacción (ej.la combustión de madera es espontánea, exergónica, pero no empieza a arder por sí misma)
LAS ENZIMAS CATALIZAN TODAS LAS REACCIONES...¿Cómo?
FUNCION DE LOS CATALIZADORES
Reducen la energía necesaria para que las moléculas estén en estado de transición, es decir, rebajan la energía de activación, son mucho más eficaces que los catalizadores químicos, rebajan mucho más
Esto se traduce en un aumento de velocidad. Ej, digestión de filete sin enzimas sería infinito, con catálisis Qº: 3 meses, y con enzimas dura 2 horas
Catalizador
•Las células pueden así reaccionar a gran v y Tª bajas.
|
|
MECANISMO DE ACCION ENZIMATICA
Los enzimas son proteínas globulares, con estructura terciaria
1-Se produce una unión íntima al sustrato modelo llave-cerradura, formándose el complejo E-S
-La unión se produce en zonas específicas: CENTRO ACTIVO, donde están los sustratos en la disposición más adecuada porque se facilita la ruptura o formación de nuevos enlaces.Además poseen aminoácidos estructurales y aminoácidos de fijación, encargados de establecer enlaces débiles con el sustrato.Constituyen el centro de fijación de la enzima

2-Modelo adaptación inducida. el centro activo no es rígido y la unión con el sustrato induce un cambio conformacional en el centro activo, que sitúa a los Aa catalíticos en la posiciópn correcta para catalizar la reacción
-Se producen reacciones con rapidez, se liberan productos y el enzima queda disponible
CARACTERISTICAS DE ENZIMAS
- La característica más sobresaliente de los enzimas es su elevada especificidad.
- Especificidad de sustrato. El sustrato (S) es la molécula sobre la que el enzima ejerce su acción catalítica.
- Especificidad de acción. Cada reacción está catalizada por un enzima específico
- Energía de activación: barrera de energía que hay que superar para que se produzca la reacción. Es la energía necesaria para:
- Alinear grupos reactivos
- Formar cargas inestables transitorias
- Reordenar enlaces
- Superada esta barrera, se llega a un estado activado o de transición en el que se produce la orientación y condiciones adecuadas para la reacción.
- Una enzima une la molécula de sustrato de forma específica en una región denominada CENTRO ACTIVO
- suele ser un bolsillo o una hendidura que se forma entre las cadenas laterales de los aminoácidos.
- Estas cadenas:
- Facilitan la unión del sustrato (especificidad de sustrato)
- Intervienen en la catálisis (centro catalítico)
- Inorgánicos : metales que se encuentran en pequeñas
cantidades, como el Zn, Mg, K...Oligoelementos
Se pueden integrar directamente en el centro activo
Sirven de puente E-S - Orgánicos :
+Grupos prostéticos, que están fuertemente unidos por enlace covalente : hemo...
+Coenzimas que son moléculas tipo vitaminas. No son específicos del enzima, pero sí del tipo de reacción, transportando grupos funcionales:
-El H : NAD, NADP, FAD, FMN (sobre DH)
-Grupo acetilo : Co A
-Fosfatos : ATP - La ecuación de Michaelis-Menten[7] describe como la velocidad de la reacción depende del equilibrio entre la [S] y la constante k2. Leonor Michaelis y MaudMenten demostraron que si k2 es mucho menor que k1 (aproximación del equilibrio) se puede deducir la siguiente ecuación:
- La ionización de aminoácidos que no están en el centro activo puede provocar modiicaciones en la conformación de la enzima.
- El sustrato puede verse afectado por las variaciones del pH.
- Algunos enzimas presentan variaciones peculiares. La pepsina del estómago, presenta un óptimo a pH=2, y la fosfatasa alcalina del intestino un pH= 12
- Exceso: se incrementa
- Ocupando temporalmente el centro activo.
- En puntos estratégicos: principio o ramificación
- Puede darse:
- Sustrato como activador
- Producto final: inhibición por retroalimentación
- Oxidoreductasa: transferencia de electrones
- Transferasa: reacciones de transferencia de grupos, siempre que no se trate de agua
- Hidrolasa: reacciones de hidrólisis, de reacción de una sustancia con agua. Ejemplo:
- Liasa: adición de grupos a un doble enlace, o formación de un doble enlace por eliminación de grupos
- Isomerasa: tansferencia de grupos dentro de la misma molécula para dar isómeros.
- Ligasa: formación de enlaces C-C, C-S, C-O y C-N por reacciones de condensación acoplados a hidrólisis de ATP
- Un código numérico encabezado por las letras EC (comisión enzima)
- Cuatro números separados por puntos. El primer número indica a cuál de los seis grupos pertenece el enzima, el segundo a la subclase dentro de la clase, y el tercero y cuarto, a los grupos químicos específicos que intervienen en la reacción.
Especificidad: si no tiene configuración adecuada, no ofrecerá la posibilidad de que se una a su centro activo y ofrecerá la posiblidad de que se una a su centro activo y no se formará complejo E-S que facilitaría la reacción.
El centro activo es una zona de la proteína formada por una serie de Aa: pueden estar muy alejados entre sí en la estructura 1ª, pero cercanos en la 3ª, con lo cual la desnaturalización = inactivación, pierde su forma.
Es variable, hay enzimas que llegan a distinguir formas L o D, actuándo específicamente con una u otra, es especificidad absoluta , otras más generales, de grupo como la sacarasa, que actúa frente a la sacarosa y a la maltosa y de clase, cuando no depende de la molécula sino del enlace: fosfatasas.
El resto de Aa ayudan a mantener la estructura tridimensional del centro activo.
2.-No forman parte del producto
3.-No se consumen
4.-Son necesarios en pequeña cantidad
5.-La acción enzimática se caracteriza por la formación de un complejo que representa el estado de transición.
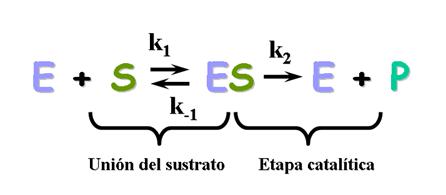
Bases de la reacción enzimática
Para que se dé una reacción química tienen que verificarse 3 condiciones:
1.- Los reactivos, llamados sustratos en enzimología, deben colisionar
2.- La colisión molecular tiene que ocurrir con una orientación adecuada (las enzimas aumentan la probabilidad)
3.- Los reactivos deben poseer suficiente energía para alcanzar el estado de transición. Esta energía se llama energía de activación. Los enzimas hacen que la reacción vaya más rápida
En las reacciones bioquímicas
Acción enzimática
El centro activo
1.- Supone una porción relativamente pequeña del volumen total de la enzima
2.- Es una entidad tridimensional
3.- Se unen a los sustratos por fuerzas relativamente débiles
4.- Son hoyos o hendiduras de las que suele quedar excluida el agua, salvo que sea un componente de la reacción
5.- La especificidad del enlace depende de la disposición de los átomos del centro activo
6.-Región que se une al sustrato y contribuye con los residuos que participan en la formación
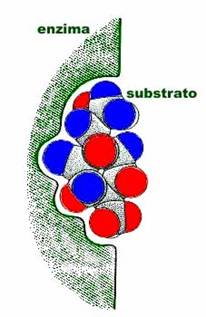
Ejemplos
ESTRUCTURA DE LOS ENZIMAS
Hay enzimas estrictamente proteicas, holoproteínas y otras qye necesitan moléculas no proteícas para realizar su función:holoenzimas, que son enzimas constituidos por la asociación de una fracción polipeptídica o apoenzima y de una fracción no polipeptídica o cofactor
HOLOENZIMA =APOENZIMA + COFACTOR
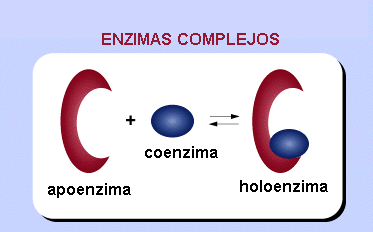
Los cofactores pueden ser:
Vamos a ver cómo funcionan los coenzimas
N A D + + 2 H + + 2 e- |
N A D H + H + | |
| N A D P + + 2 H + + 2 e- | N A D P H + H + | |
| FA D + + 2 H + + 2 e- | FA D H 2 |
Ésta es la estructura del NAD y NADP, dependiendo de la existencia de P, y del FAD. Son nucleótidos.
Si tenemos en cuenta que las reacciones metabólicas son Reacciones de oxidación-reducción, entenderemos que todo lo que veamos de ahora en adelante, va a transcurrir gracias a estos coenzimas.
¿COMO TRANSCURRE UNA REACCION CATALIZADA?
|
|
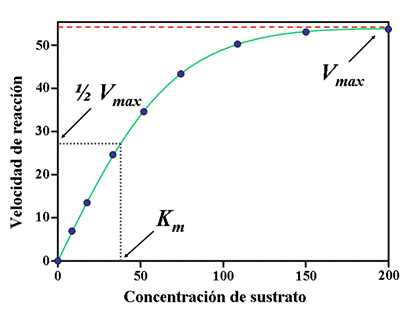
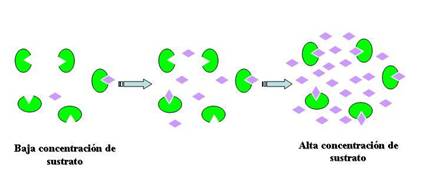
Todas las reacciones catalizadas por enzimas presentan una particularidad propia: la saturación por el sustrato
A baja [s], la v aumenta al ir aumentando la [s].Conforme aumenta la [s], la v deja de aumentar proporcionalmente, hasta que la velocidad permanece constante: es decir la enzima llega a saturarse.La gráfica es característica de cada enzima.
FACTORES QUE INFLUYEN EN LA ACTIVIDAD ENZIMATICA
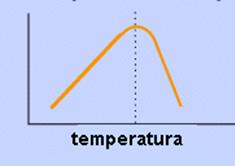
1.-TEMPERATURA
-La actividad aumenta con la Tª..Se llega a un valor máximo de la Tª: óptima, con un máximo de actividad
-Al aumentar la Tª aumenta la energía de las moléculas y acanzarán más rápidamente un estado de transición
-Al aumentar mucho la Tª la proteína se desnaturaliza, desordenándose su estructura y perdiendo su actividad
-La mayoría se desnaturalizan entre 55 y 60º.
-Por baja Tª no se desnaturalizan, por eso, los animales poiquilotermos tienen necesidad de hibernar
Los gatos siamenses tienen enzimas responsables de la pigmentación del pelo que funcionan con actividad máxima a Tª inferiores al resto del cuerpo
2.-pH.
-La actividad enzimática es máxima para ciertos valores: pH óptimo. siendo éste muy variable de unos a otros (1,5-10)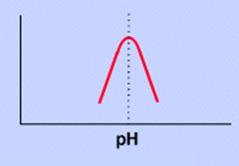
El centro activo puede contener aminoácidos con grupos ionizados que pueden variar con el pH.
-Las cadenas laterales de algunos Aa presentan grupos funcionales que a determinados pH presentan carga eléctrica.Estos pueden relacionarse con otros mediante interacciones no covalentes y contribuyen a la estructura tridimensional de la proteína o del centro activo.Si varía el pH determinadas interacciones no pueden ocurrir, lo que alteraría desde la estructura del centro activo hasta la interacción con el sustrato.Pequeñas variaciones en el pH ocasionan grandes cambios en la actividad del enzima.
-El pH óptimo varía para los distintos enzimas: la pepsina a pH ácido y la tripsina a pH básico.
3.-Concentración de enzima y sustrato:
3.-INHIBICION ENZIMATICA
Un inhibidor es una molécula capaz de emular específicamente la actividad enzimática.
-En muchos casos para poder establecer el sustrato correcto de una enzima se han utilizado moléculas de estructura química muy parecida que pudieran competir con ella.Con estos inhibidores ha sido posible descubrir la naturaleza del centro activo e identificar los grupos funcionales responsables de la acción.
3.1.IRREVERSIBLES: son compuestos que se unen irreversiblemente a determinados grupos del centro activo y anulan su capacidad catalítica.Ej: venenos y toxinas
3.2.REVERSIBLES : no se inutiliza el centro activo, sólo se impide temporalmente su funcionamiento.
3.2.3.Competitiva: presencia de inhibidores , que son moléculas muy similares al sustrato.Si se fija el inhibidor, la enzima no cataliza.
Características
•Es reversible
•Depende del nº de moléculas de inhibidor y de sustrato.
edumedia
3.2.4.No competitiva: o actúa sobre el complejo E-S haciéndolo fijo
o se une a la enzima impidendo el accesoCaracterísticas
•El inhibidor se une en otro sitio distinto•Dificulta la unión con el sustrato•Es reversible
4-CONCENTRACION DE SUSTRATO
Al aumentar la concentración, aumenta la Probabilidad de encuentro
Si aumenta mucho, se produce saturación de enzimas
KM depende de la afinidad enzima sustrato y es la [s] en que la v= 1/ Vmáx
5.-ACTIVADORES: algunos iones favorecen la unión E-S.Así la fosforilasa que regula la formación de ATP y se ve activada por la presencia de Mg2+
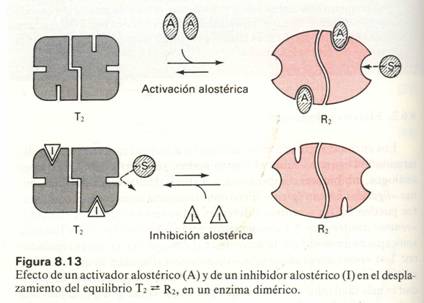
ENZIMAS ALOSTÉRICOS
Están formados por varias subunidades o protómeros.Cada protómero posee dos centros: el regulador y el catalítico
Al unirse el activador al centro regulador, la conformación varía haciéndose funcional el centro catalítico.Así pasa del estado inhibido (T) al catalítico (R).La variación en la conformación se transmite a otros protómeros haciéndolos activos: Transmisión alostérica.
Existen enzimas que adoptan al menos dos conformaciones distintas y estables: activa e inactiva.El paso de una a otra está inducida por la unión de los ligandos a determinados lugares de la superficie enzimática:centros reguladores
Unos se encuentran inhibidos y requieren un activador (el S) para pasar a estado catalítico.
Otros, en estado catalítico y la unión del producto con el regulador induce a un estado inhibido.Es el efecto feed-back y supone un ahorro energético
|-------E1 E2 E3
Sustrato ------ A -----------B ---------- C
E1 E2 E3
Sustrato ------ A -----------B ---------- C
|________________________________|
Alosterismo
NOMENCLATURA Y CLASIFICACION
El nombre de cada enzima puede ser identificado por: